本文是一篇临床医学论文,本研究表明bLF在体外具有明显的抗A549细胞活性,但bLF对A549细胞的抑制作用还未详细揭示,bLF的抗肺癌机制还需进行更多的实验挖掘,后续体内抗癌作用后期还需进一步深入研究,这些问题将是未来研究的重点。
第一章文献综述
1肺癌及其研究现状
肺癌是肺部病变细胞“有增无减”增殖后形成的瘤体,其发病率和死亡率较高且呈现持续不断增长的趋势[1]。根据全球癌症统计数据显示,每年约有超过200万人被新诊断为肺癌[2,3];其中约有一半在亚洲[4]。在过去的几年里,中国的肺癌发病率和死亡率一直呈上升趋势[5]。根据国际癌症研究机构报告的统计显示,仅2020年,中国约有82万新确诊肺癌患者和71.5万肺癌相关死亡病例。并且,据专家推测,各国肺癌新发病例数将持续上升[3]。作为高危性恶性肿瘤的代表,肺癌不仅存在于人类,在动物中也频发,也是导致动物死亡的主要危险因素之一。因此研究肺癌的防控与治疗,对于保护人/畜安全具有重要意义。
肺癌可分为两种主要亚型:非小细胞肺癌(Non-small cell lung cancer,NSCLC)和小细胞肺癌(Small cell lung cancer,SCLC)。其中,NSCLC占总肺部肿瘤病例的85%[6]。近几十年来,不同分子靶点的发现使得针对NSCLC的靶向治疗成为热点。尽管取得了诸多进展,但由于肺癌的早期发病症状不明显,多与肺结核、肺炎等疾病表现特征相同,因此易导致患者忽视病情[7]。而癌细胞突破正常细胞的“生命规律”,在体内增殖的速度迅猛,多数肺癌患者确诊时已进入疾病的进展期或晚期,此时治愈性手术选择有限,NSCLC患者的五年平均生存率仅为23%-27%[1]。近年来,微创技术在利用胸外科手术治疗早期肿瘤方面取得了许多进展,但局部肿瘤患者的五年生存率仍仅为64%,这表明尽管这些肿瘤被诊断为早期阶段,但其侵略性仍不可忽视。而当NSCLC到晚期时,大多数患者会出现合并症,此时可使用的手术方法会受到极大限制。此外,超过70%被诊断为NSCLC的患者存在局部或转移性淋巴播散,使其五年生存率分别下降到7%和33%[8]。
...............................
2乳铁蛋白简介
乳铁蛋白(Lactoferrin,LF)是转铁蛋白家族一种兼具多种生物学功能的阳离子铁结合糖蛋白(等电点约为9),存在于大多数哺乳动物的外分泌物中,包括乳汁、眼泪、唾液和汗液等[52]。LF也在中性粒细胞的次级颗粒中高浓度存在,并在病原体感染时可被分泌于血液中,是宿主先天免疫系统的重要组成部分[53]。在人类、小鼠和牛中,LF的同源性很高。其中,人源与牛源LF间的同源性可达78%[54]。LF的二级结构主要是由两个对称且高度同源的叶状结构(N叶和C叶)交替排列在α螺旋和β叶片上组成(图1)。N叶对应肽链中的1-333位氨基酸残基,且其末端富含碱性残基,而C叶对应345-692位氨基酸残基。此外,N叶和C叶通过小肽键(氨基酸334-344)连接,形成“两个银杏叶型”的整体结构,每个叶均具有不同的铁结合位点[55]。在碳酸盐存在下,每个叶都能够可逆地结合Fe3+,最大结合量为1.4mg Fe3+/g蛋白质。除了Fe3+,其他一些金属离子,如Zn2+、Cu2+和Mn3+也可以与LF结合。LF可分为缺铁乳铁蛋白(Apo-LF)(铁饱和度低于5%)和铁饱和乳铁蛋白(Holo-LF)(铁饱和度在85%以上)[56]。在生理条件下,天然LF呈现15%-20%的铁饱和率;并且,LF还能通过形成不同的铁饱和率,在机体感染和发炎部位通过减少游离铁诱导活性氧(Reactive oxygen species,ROS)的形成和自由基损伤[57]。
目前所发现的两种LF多肽(LFcin和Lactoferrampin)都包含LF生物学功能较为丰富的区域。这些带正电的多肽在生理上参与肠道内稳态,包括抗微生物和抗癌[58,59]。并且,由于携带正电荷,LFcin和Lactoferrampin均可与带负电荷的病原体或癌细胞表面相互作用,从而诱导细胞溶解,起到杀伤作用[60]。迄今为止,人们对LF在抗真菌、抗病毒和提高免疫力等方面展开了详细的研究;随着研究的深入,科研人员发现LF可以特定的识别癌细胞,并具有明显的抗癌活性,其具体作用机理也正在被进一步发掘[54,61]。
............................
第二章bLF对A549细胞增殖及迁移的影响
1实验材料
1.1细胞系
人胚肺成纤维细胞MCR-5、幼仓鼠肾传代细胞BHK-21由生物医学研究中心生物工程与技术国家民委重点实验室保存并提供;人肺腺癌细胞A549由兰州民海生物工程有限公司惠赠。
1.2主要药品
牛乳铁蛋白(Bovine lactoferrin,bLF),购自成都麦克林生物科技有限公司,用无菌纯水配制成浓度为50mg/mL储液,并于-80℃保存。
1.3主要仪器设备
临床医学论文参考
............................
2实验方法
2.1细胞培养
(1)取出液氮中保存的BHK21、MRC-5和A549细胞,在37℃水浴中快速解冻(管口保持在水面上方),800 r/min低转速离心5 min后,弃去冻存液。
(2)将MRC-5和A549细胞转移至含10%FBS的F12完全培养基中,BHK21细胞转移至含10%FBS的DMEM完全培养基中,于37℃、5%CO2条件下培养12 h,在倒置显微镜下观察细胞是否开始贴壁生长,待细胞贴附到瓶壁上后,更换一次培养基,然后继续培养,直到细胞生长密度至85%以上时进行传代。
(3)弃去原有细胞培养液,加入2 mL无菌1×PBS洗涤细胞两次,加入2 mL胰蛋白酶,培养箱静置消化1 min,当观察到细胞处于流沙状脱落时,加入5 mL完全培养基,使用无菌吸管反复吹打培养瓶内壁,使细胞充分脱落分离,按所需细胞数移至新的细胞瓶中并继续培养。
2.2细胞计数
(1)在进行血球计数之前,为避免在计数过程中出现误差,先通过显微镜观察计数板中的计数室,如发现有杂物或污垢,需要使用酒精进行清洗,并待其晾干后才能使用。
(2)在上述干净的血球计数板上,盖上配套盖玻片,然后用移液枪吸取适量稀释后的细胞悬液,小心地滴入盖玻片下方,让培养液缓慢渗透进计数室。该过程需特别注意避免产生气泡,以确保得到准确的计数结果。
(3)当细胞都沉淀到计数室底部时,将计数板放在显微镜载物台的中间位置,并按照以下公式进行计数:细胞悬液细胞数/ml=4个大正方形内之细胞数目之和×稀释倍数×104)/4。注意,对于处于边界位置的细胞,为得到最准确的血球计数结果,只需要计算上边界和左边界处细胞,或计算下边界和右边界处细胞。
......................
第三章 bLF调控A549 细胞凋亡的作用机理初探 ................... 33
1 实验材料 ............................. 33
1.1 细胞系 ................................... 33
1.2 主要药品 .................................. 33
第四章 结论................................... 44
第三章bLF调控A549细胞凋亡的作用机理初探
2实验方法
2.1细胞培养
参照第二章2.1部分。
2.2 Hoechst 33342细胞核染色
将生长状态良好的A549细胞制成悬液,调整细胞密度为3×105个细胞/mL,在6孔板中每孔接种1 mL细胞悬液,12h后,分别用0.5,1.0和1.5 mg/mL浓度的bLF分别处理细胞24 h,小心去除原细胞液,用1×PBS清洗6孔板细胞并其余清洗液,各孔分别加入1 mL 4%多聚甲醛,室温固定20 min,弃掉固定液,1×PBS清洗两遍,加入适量Hoechst 33342染色液没过细胞,37℃染色20 min,弃去染色液,1×PBS洗涤细胞3次,避光环境在荧光显微镜下观察细胞染色情况,并拍照记录。
2.3流式细胞术检测细胞凋亡
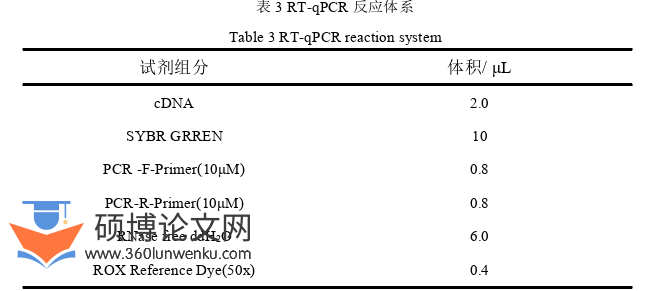
将生长状态良好的A549细胞制成悬液,按照3×105个细胞/孔均匀地接种于6孔板培养过夜,待细胞贴附且达到70-80%的汇聚度后。小心去除原培养基,用预冷的1×PBS温和清洗细胞,以去除漂浮细胞。随后加入不同浓度的bLF(终浓度分别为0,0.5,1.0和1.5 mg/mL)继续孵育24 h。24 h后使用适量胰蛋白酶对孔内细胞进行消化,并随时观察细胞直至消化完全,弃去孔内胰蛋白酶,加入2mL完全培养基轻柔吹打并转移细胞悬液于新的无菌2 mL收集管中。低速离心10 min(1,000 rpm/min),弃去上清液,并用预冷的无菌1×PBS重悬细胞,再次低速离心10 min,此过程重复2次。用含有膜联蛋白V-FITC和PI的缓冲液重悬细胞沉淀,轻柔混匀后,在避光条件下室温反应15 min,之后转移至流式细胞检测试管中完成上机检测,收集并分析数据。使用GraphPad Prism 8软件绘制统计柱状图。
临床医学论文怎么写
...............................
第四章结论
bLF作为一种抗癌活性较高的天然蛋白,对肺癌A549细胞生长的抑制作用机制尚不清楚。本论文以肺癌A549细胞为模型,体外细胞实验初探了bLF抑制A549的分子机制。具体结论如下:
(1)bLF对A549细胞具有较强的杀伤效果,可抑制A549细胞的克隆形成,且其毒性作用呈现浓度依赖性。
(2)bLF通过调控周期相关蛋白及因子,将A549细胞周期阻滞在S期,且S期比例随着bLF浓度的增加而升高。
(3)bLF可通过调控部分迁移相关因子,进而抑制A549细胞的迁移能力。
(4)bLF上调P53基因并增强了促凋亡蛋白Bax与Caspase3的表达,同时抑制了抑凋亡蛋白Bcl-2的表达,以促进A549细胞发生凋亡。(5)bLF增强了A549细胞内ROS浓度,激活线粒体凋亡途经从而诱导A549细胞发生凋亡。
综上,本研究表明bLF在体外具有明显的抗A549细胞活性,但bLF对A549细胞的抑制作用还未详细揭示,bLF的抗肺癌机制还需进行更多的实验挖掘,后续体内抗癌作用后期还需进一步深入研究,这些问题将是未来研究的重点。
参考文献(略)
