本文是一篇临床医学论文,根据实验数据,PCA通过恢复心脏功能标记物(肌酸激酶MB、乳酸脱氢酶和心肌肌钙蛋白)的水平,对ISO诱导的大鼠心肌梗死发挥了心脏保护作用。
1.材料和方法
1.1实验材料
1.1.1实验动物
本研究开展前已通过河南省胸科医院伦理委员会伦理审查,伦理审批编号为:2021041901。选取雄性Wistar白化大鼠(年龄为12周,体重180–200克。购自于河南省实验动物中心)进行实验。实验之前,大鼠在温度可控(25±2°C)、有12小时的明暗交替期的环境中饲养了10天。它们可以自由获得标准的啮齿动物饮食。
1.1.2实验主要试剂

临床医学论文参考
.......................
1.2实验方法
将所有35只大鼠从1到35编号,电脑随机数字分为五组(每组7只)。
对照组:动物灌胃法(下同)口服0.9%氯化钠(5ml/kg)14天,最后两天背部皮下注射生理盐水(2ml/kg)每日一次,间隔24小时。
PCA200组:动物口服PCA(200mg/kg)(货号:37580)14天,最后两天背部皮下注射生理盐水(2ml/kg)。
ISO组:动物口服0.9%氯化钠(5ml/kg)14天,并在最后两天背部皮下注射ISO(85 mg/kg)(货号:15627)以诱发MI[24]。
PCA100+ISO组:动物口服PCA(100 mg/kg)14天,最后两天背部皮下注射ISO(85mg/kg)诱导MI。
PCA200+ISO组:动物口服PCA(200 mg/kg)14天,最后两天背部皮下注射ISO(85 mg/kg)诱导MI。
采用预处理的方法在模拟心梗模型前口服PCA。所有大鼠每天监测心电图,观察ST-T段变化情况,并观察大鼠行为变化。发现ST段明显抬高同时出现活动较前迟缓,提示符合实验预期效果。接下来如果血清心肌损伤标记物也同时升高,则提示造模成功。预实验时选择不同剂量(50、100和200mg/kg)的PCA,在较高剂量(100和200 mg/kg)下观察到有效的心脏保护作用。PCA组在灌胃时,根据原分组计划200mg/kg或100mg/kg的标准对每只大鼠称取PCA,按每100g大鼠体重添加0.5ml生理盐水的比例配置充分摇匀后灌胃灌入。异丙肾上腺素溶液配制,510mgISO粉末溶于12ml生理盐水中。所有受试动物在第15天被颈椎脱位法处死,并采集心脏和血液样本。称重心脏组织,并在预冷条件下清洗两次(50 mM Tris–HCl,pH 7.4)。病理和免疫组织化学检查时,心脏保存在10%中性福尔马林缓冲液中。
..............................
2.结果
2.1 ISO介导心脏毒性后PCA对心脏损伤标记物的影响
如图1所示,与对照组相比,ISO注射引起血清CK、LDH和CTnT水平显著升高(P<0.05)。与模型组相比,ISO注射前补充两种试验剂量的PCA显著减弱了模型组的CK、LDH和CTnT升高。
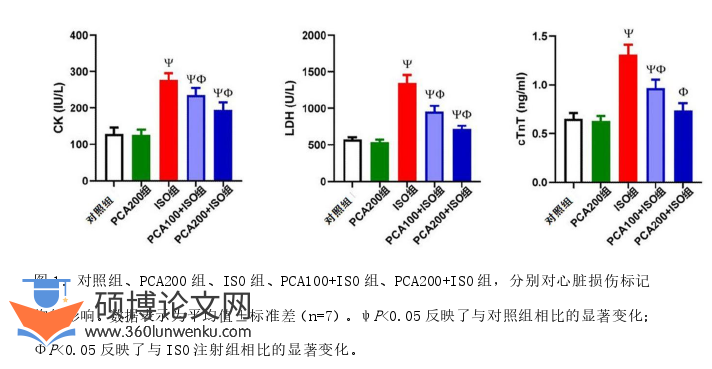
临床医学论文怎么写
......................................
2.2在ISO介导的心脏毒性后,PCA对氧化还原稳态的影响
与对照组相比,ISO介导的MI大鼠在丙二醛(MDA)和一氧化氮(NO)生成方面增加,提示膜脂质过氧化增加,表明ISO对心脏组织的氧化作用。注射ISO后,天然抗氧化剂(即CAT、SOD、GSH、GPx和GR)中的含量显著减少(P<0.05)。PCA给药后的大鼠比注射ISO的大鼠氧化还原状态显著改善,表现为过氧化产物(MDA和NO)减少,细胞抗氧化剂(CAT、SOD、GSH、GPx、GR)增强(图2)。
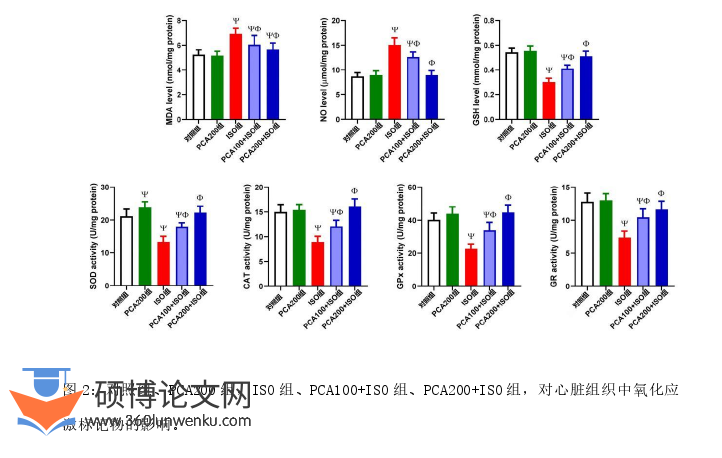
临床医学论文参考
................................
结果····························9
讨论····························10
结论······················12
3.讨论
在探讨PCA对ISO介导的心肌梗死大鼠模型保护作用的实验中,我们的数据显示血清CK、LDH和CTnT水平显著升高,证实了ISO注射后诱导产生MI,这与其他文献一致[3,33]。ISO注射会引起心脏过度活动,增加氧气和供血需求,从而导致心肌缺血和能量不足[34]。由于心肌收缩力增加导致心肌细胞受损,干扰细胞膜的通透性和完整性,从而使心肌损伤相关标志物释放到血液循环中[3,35]。CK、LDH和CTnT起源于心脏组织,它们在血流中的出现表明了MI的存在[36]。这也与早期文献[3]一致。并且组织病理学改变证实了ISO注射后实现了MI的诱导。另一方面,PCA预处理减少了CK和LDH向血液中的释放,反映出PCA可增加ISO注射后的膜稳定性,起到保护心肌的作用。
氧化还原稳态紊乱是心肌梗死发病机制的重要病理特征[37]。我们所研究实验中ISO注射后心脏组织显示出严重的氧化损伤,MDA和NO(脂质过氧化指标)生成增加,抗氧化分子减少证实了存在氧化还原的失衡。ISO注射导致Nrf2和HO-1的mRNA表达显著下调,这和其他ISO注射后诱导大鼠心肌梗死的结果一致[37]。有人认为,ISO注射液刺激β-肾上腺素能受体,从而增强心脏组织中的ROS形成和脂质过氧化[38]。过多的脂质过氧化扰乱线粒体功能,增加ROS生成,并消耗细胞抗氧化能力[39]。NO是一种参于许多生理过程的介质。然而,NO在高浓度下与超氧自由基相互作用,形成强大的氧化分子--过氧亚硝酸盐,导致严重的细胞损伤[40]。与MI诱导相关的内源性抗氧化剂耗尽可能是因为它们耗尽并用于灭活ISO注射产生的ROS[41]。我们观察到,PCA治疗抑制了心肌中氧化应激的发展,降低了MDA、NO和NOS2的mRNA表达。此外,PCA提高了实验中所检测抗氧化剂的含量和活性,上调了Nrf2和HO-1。而PCA的抗氧化性能可能被认可为提供氢原子或电子,使其能够螯合金属离子并清除自由基[42]。近期的报告显示,PCA降低了大鼠神经系统MDA和NO水平,增加了GSH及其衍生抗氧化酶,以及CAT和SOD,以应对镉和砷中毒[14,43]。此外,还有文献发现PCA可抑制与甲萘醌介导的肝组织氧化损伤相关的氧化应激。PCA的抗氧化作用模式可能是通过Nrf2的激活,控制和调节细胞抗氧化起到保护作用[22]。
.............................
4.结论
1.根据实验数据,PCA通过恢复心脏功能标记物(肌酸激酶MB、乳酸脱氢酶和心肌肌钙蛋白)的水平,对ISO诱导的大鼠心肌梗死发挥了心脏保护作用。
2.PCA恢复了促氧化剂(丙二醛和一氧化氮)、Nrf2及其在心脏组织中的下游抗氧化分子和抗氧化系统之间的失衡。
3.PCA抑制了大鼠心脏组织中的炎症介质(肿瘤坏死因子-α、白细胞介素-1β和核因子-κB)、凋亡和纤维化。
参考文献(略)
