本文是一篇临床医学论文,本研究结果显示绵羊TCs表达MTR,MT抑制其增殖和凋亡,促进MTR表达与孕酮分泌;病理条件下,抑制TCs雄激素过度分泌、ROS含量升高和焦亡损伤,恢复孕酮分泌和细胞活力。
第1章 文献综述
1.1 卵巢TCs及其功能的研究进展
卵巢(Ovary)是雌性哺乳动物重要的生殖器官。随着机体的发育,卵巢会发生持续的动态变化。TCs最先出现在次级卵泡中,在三级卵泡中发育成为卵泡膜组织。膜组织由两层组成,外层称为外膜(Theca externa,TE),内层称为内膜(Theca interna,TI),外膜细胞具有平滑肌细胞的细胞学特征,而内膜细胞呈上皮样,是典型的类固醇生成细胞。卵泡是卵巢结构和功能的基本单位,主要由Oocytes、GCs和TCs三种细胞组成。卵泡发生的过程受这些细胞的信号调控,表现为三种细胞的生长、分化、成熟或凋亡,最终实现排卵或闭锁。TCs是卵泡的重要组成部分,其能够参与卵泡的正常发育与闭锁。尽管目前对TCs的研究一直被忽视,但TCs在卵泡发生中的作用是至关重要的。TCs既是卵泡结构基础,又是卵巢雄激素的唯一分泌细胞。卵泡膜层的形成涉及到卵巢细胞的招募、生长以及血管结构的发展,受到由来自Oocytes和GCs的复杂调控。同时,TCs也能产生各种参与调节卵泡功能的因子。研究TCs的招募、分化和功能将有助于我们系统地阐述卵泡的形成和发育机制,提高卵泡的质量和胚胎的发育潜力,并在临床上治疗多囊卵巢综合症(Polycystic ovary syndrome,PCOS)、卵巢早衰(Premature ovarian failure,POF)和其他可能涉及TCs功能紊乱的疾病。
1.1.1 TCs的来源
卵泡膜内膜由具有类固醇生成功能的膜细胞、血管和免疫细胞组成,外膜是由成纤维细胞形成的纤维结缔组织层[1]。卵泡膜内膜主要起营养和信号交流的作用,通过血管结构将营养物质输送到无血管结构的颗粒细胞层、卵丘细胞和卵母细胞;同时,TCs会分泌关键的内分泌调节因子,如雄激素(睾酮和双氢睾酮)、孕酮和生长调节因子,如骨形态发生蛋白(Bone morphogenetic protein, BMP)和转化生长因子-β(Transforming growth factor-β, TGF-β)[2],参与与GCs、Oocytes的信号交流,维持卵泡发育中功能细胞的同步发育。外膜主要为维持卵泡的形态结构。绵羊卵泡完整发育过程中,利用电子显微镜对TCs结构进行观察,发现小卵泡的膜层组织由扁平的TCs以及靠近基底膜的毛细血管和胶原纤维组成[3]。
........................
1.2 MT在雌性生殖领域的研究进展
1.2.1 MT的抗氧化作用
MT作为一种抗氧化剂,可直接清除自由基。MT存在于细胞质和细胞核中,通过直接清除和间接抗氧化作用,限制所有细胞中的氧化应激,保护DNA和其他成分免受氧化应激损害。MT及其代谢物均具有抗氧化作用[52]。MT还通过MTR间接增加抗氧化酶活性,包括超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathioneperoxidase,GPx)[53]。
1.2.2 卵泡MT的来
MT通过芳香胺-N-乙酰基转移酶(N-acetyltransferase,AANAT)和羟(基)吲哚-O-甲基转移酶(Hydroxyindole-O-methyltransferase,HIOMT)的顺序作用,由5-羟色胺酶(Serotonin/5-Hydroxytryptamine,5-HT)合成[54-56]。AANAT和HIOMT是合成MT的关键酶,也是决定组织或细胞是否合成MT的关键酶[56]。MT是脂溶性,也是水溶性的,可以轻易地穿过细胞膜,它不仅存在于血液中,也存在于体液中,包括脑嵴液、卵泡液和精液。卵泡液中的MT不仅来源于卵泡细胞的自我分泌,还富集于血液。在卵泡发育的不同阶段MT来源不同[57]。牛和猪卵泡液中MT的生理浓度约为10-10M[58]。AANAT和HIOMT在大鼠和人的卵巢中表达,AANAT和HIOMT对卵巢中底物的亲和力与松果体中的亲和力大致相当,这表明卵巢也可以高效合成MT[59]。大鼠[60]和绵羊[61]卵丘-卵母细胞复合体(Cumulus oocyte complesx,COCs)中的AANAT水平从原始卵泡到有腔卵泡逐渐增加,表明在腔前卵泡中卵泡细胞自身合成是卵泡中MT的主要来源。随着卵泡直径的增加卵泡液中MT浓度呈现升高趋势,但COCs合成MT的能力却在下降[61]。随着有腔卵泡的发育,卵泡膜分化为内外双层,内膜血管组织的数量增加使得卵泡液和血液之间的MT交换更易于实现,使得有腔卵泡中MT主要来源于循环血液[62, 63]。
............................
第2章 发情期绵羊卵泡膜的发育规律与MTR的表达
2.1 材料与方法
2.1.1 试验材料
2.1.1.1 实验动物
在甘肃省永登县某定点畜禽屠宰检疫场采集成年绵羊卵巢组织。通过观察羊群和公羊人工查情等方法,选择发情绵羊3头,绵羊经颈部放血处死后立即打开腹腔,视诊选择无病变且处于排卵期的卵巢,用灭菌剪刀采集卵巢组织。用无菌PBS冲洗表面血污后将完整卵巢放入含4%甲醛的固定液中,24 h后更换固定液。卵巢组织固定7天后进行后续试验。
2.1.1.2 主要仪器
电子天平(上海越平科学仪器公司,FA1004B)、组织刀片(德国徕卡公司,Leica,819)、多聚赖氨酸载玻片(武汉塞维尔生物科技公司,Servicebio,REF.G6012-1)、组织切片机(Leica,RM2235)、生物组织摊烤片机(金华益迪医疗设备公司,YD-AB2)、免疫组化笔(Servicebio,G6100)、移液枪(青岛佳鼎分析仪器有限公司,Reference2)、光学显微镜与成像系统(奥林帕斯,Olympus,BX51)。
2.1.1.3 主要试剂与配置
甲醛(湖北成丰化工有限公司)、酒精(天津市汇抗化工科技有限公司)、二甲苯(天津市富宇精细化工有限公司)、苏木精(上海吉至生化科技有限公司,H69840)、曙红Y(上海中秦化学试剂有限公司)、酸性分化液(Servicebio,G1039)、中性树脂(北京索莱宝科技有限公司,Solarbio,G8590)、Masson三色染色试剂盒(Solarbio,G1340)、柠檬酸抗原修复液(Servicebio,G1202)、PBS缓冲液(大连美仑生物技术有限公司,meilunbio,MA0015)、牛血清白蛋白BSA(Solarbio,A8010)、3%H2O2(山东德新康医疗科技有限公司,201003)、Rabbit Anti-MT2 antibody(北京博奥森生物技术有限公司,Bioss,bs-0963R)、Rabbit Anti-MT1 antibody(Bioss,bs-0027R)、免疫组化试剂盒(含HRP标记山羊抗兔二抗)(Servicebio,G1215)、返蓝液(Servicebio,G1040)。
...........................
2.2 结果
2.2.1 绵羊卵泡膜组织学结构观察
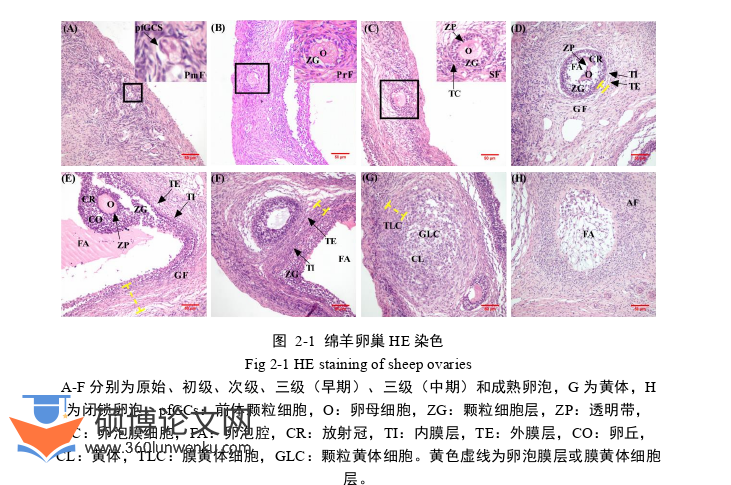
通过HE染色和Masson染色,结果如图2-1和2-2所示,绵羊卵巢组织切片中可见各级卵泡结构。原始卵泡和初级卵泡中未见TCs,TCs最早出现在次级卵泡中,有腔卵泡中形成膜结构并分化为TI和TE。闭锁卵泡中,TCs发生凋亡,卵泡膜组织完整性被破坏,结构丧失,卵巢髓质间质细胞向着闭锁卵泡腔体内明显增生,以填充腔体。成熟卵泡靠近卵巢皮质,卵泡腔发育至最大。黄体形成过程中,TCs向卵泡腔内增殖并分户形成膜黄体细胞。膜黄体分布在黄体外围,数量较内部颗粒黄体细胞少。
通过测定膜组织厚度,结果如图2-3所示,绵羊次级卵泡发育至成熟卵泡前,卵泡膜组织厚度显著增加(P<0.05),成熟卵泡阶段膜组织厚度显著降低(P<0.05),黄体形成时,膜黄体细胞层显著增厚(P<0.05)。
临床医学论文怎么写
..............................
第3章 绵羊TCs体外分离培养与优化 ........................... 27
3.1 材料与方法 ................................. 27
3.1.1 试验材料 .................................. 27
3.1.2 试验设计 ..................................... 29
第4章 MT对绵羊TCs发育和激素分泌的影响 .......................... 39
4.1 材料与方法 ............................... 39
4.1.1 试验材料 ....................................... 39
4.1.2 试验设计 ................................... 40
第5章 MT 对 LPS 诱导 TCs 焦亡的影响 ............................ 53
5.1 材料与方法 ............................ 53
5.1.1 试验材料 ................................... 53
5.1.2 试验设计 .............................................. 54
第5章 MT对LPS诱导TCs焦亡的影响
5.2 结果 5.2.1 LPS诱导TCs焦亡
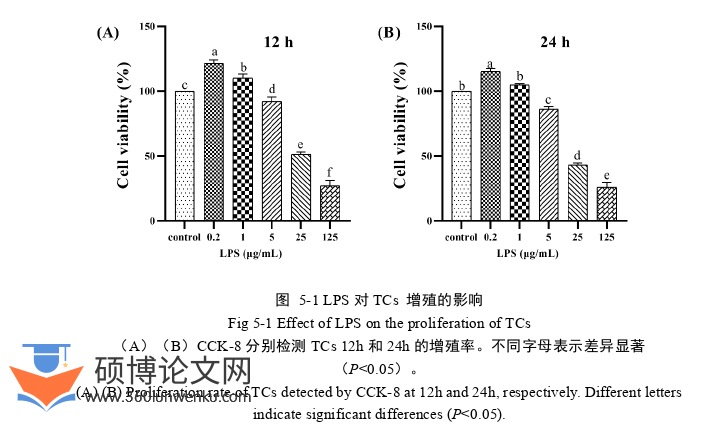
5.2.1.1 LPS对TCs增殖的影响
结果如图5-1所示,LPS作用12 h时,0.2和1 μg/mL LPS组增殖率显著升高(P<0.05);5、25和125 μg/mL LPS 组增殖率显著降低(P<0.05)。作用24h时,0.2 μg/mL LPS组增殖率显著升高(P<0.05),5、25和125 μg/mL LPS 组增殖率均显著降低(P<0.05),1 μg/mL LPS组增殖率无显著性差异(P>0.05)。以上结果提示低浓度LPS可促进TCs增殖,但高浓度LPS可抑制体外培养绵羊TCs增殖,且抑制作用随着作用时间的增加而增强。
临床医学论文参考
..........................
主要研究结论
1. 卵泡膜在卵泡发育和黄体形成中均发挥着重要作用,在卵泡发育中卵泡膜MTR表达具有阶段差异性。
2. 绵羊TCs体外分离培养最佳条件为内膜组织消化时间为30 min,培养血清浓度为15%、培养温度为38℃、CO2浓度为5%,适宜培养液为DMEM/F12和DMEM高糖培养液。
3. MT抑制TCs增殖和凋亡,这对于减缓卵泡闭锁和保护卵巢储备有着一定的积极影响。
4. MT通过MTR/SIRT1/SOD2/ROS通路抑制TCs焦亡,表明卵巢功能细胞对炎性焦亡具有一定的先天抵抗能力,这对于使用MT预防和治疗卵巢炎性疾病引起的功能障碍具有一定的实践意义。
参考文献(略)
