本文是一篇临床医学论文,本研究通过对高脂饮食饲养并长期短暂性低氧环境下小鼠的肝脏进行RNA-seq分析,检测到参与高脂饮食诱导的长期短暂性低氧环境下适应的差异基因,且GO分析显示这些差异基因大多数集中在脂质代谢相关的功能模块。
第1章引言
1.1非酒精性脂肪
肝非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确的损肝因素外,以弥漫性肝细胞大泡性脂肪变以及脂质代谢紊乱为主要特征的临床病理综合征[1]。在病理学上,NAFLD呈现不同病理进程,包括单纯性脂肪变性(Simple steatosis)、非酒精性脂肪性肝炎(Nonalcoholic steatosishepatitis,NASH)、非酒精性脂肪纤维化(Nonalcoholic fatty liver fibrosis)、肝硬化(Cirrhosis)和肝细胞癌(Hepatocellular carcinoma)。随着肥胖和相关代谢综合征发生率的增加,NAFLD已经成为最常见的肝病之一,世界上约有25%的人口患有非酒精性脂肪肝,并随着年龄的增长而增加[2]。
NAFLD的发生发展源于肝脏脂质的过度积累,与过高的脂肪摄入有关[3]。尽管NAFLD发病机制仍然是个谜,但“双重打击”假说被较为广泛的接受,提出了从正常肝脏到肝脏脂肪变性再到NASH的逐步发展过程[4]。该理论假设胰岛素抵抗是“第一个打击”,促进肝脏中脂肪酸的积累,导致肝脏脂肪变性[5]。胰岛素抵抗导致外周脂肪组织的脂肪分解能力受损,并改变肝脏相关基因转录,从而促进游离脂肪酸进入肝脏和肝脏新生脂肪运出受损,导致脂肪堆积[5-7]。氧化应激是“第二个打击”,导致脂肪酸氧化增加,并促进活性氧形成、脂质过氧化、DNA损伤、线粒体功能障碍和促炎细胞因子释放。这些机制导致肝细胞损伤、炎症和纤维化,形成了脂肪性肝炎的特征[8,9]。肝脏中的脂肪沉积(第一次命中)增加了对危险因素的易感性(第二次命中),这会引发NAFLD导致更严重的NASH,甚至肝硬化和肝细胞癌[10]。最近,又有人提出“多重平行撞击”假说,其中多种细胞机制同时作用,形成“风暴”导致肝脏炎症并进一步发展为NASH[11]。
............................
1.2低氧环境和代谢综合征
一项针对人类肥胖的研究报道,生活在高海拔地区的儿童和青少年肥胖患病率较低[18]。在动物实验中,也得到了同样的结果[19]。这些发现为研究在缺氧或者生活在高原下减肥的可能性打开了大门。高原地区较平原地区而言,最重要的差别表现在氧浓度低、温度低和气压低三方面。已经有学者表明[20]冷环境可以通过提高能量代谢及葡萄糖和脂肪酸的利用率改善肥胖,在一系列研究中发现[21],缺氧条件下观察到的体重减轻,与氧气浓度—缺氧/常氧周期—缺氧时间有关,与大气压强无关。“氧”作为线粒体呼吸链中的最终电子受体,对维持正常的组织稳态和代谢至关重要[22]。目前的研究证明,在缺氧条件下,体重减轻的主要部分是由于脂肪量的减少[23]。
慢性间歇性低压缺氧(Chronic intermittent hypobaric hypoxia,CIHH)通过低压和低氧条件模拟高原环境。先前的研究表明,CIHH对身体的各种组织具有有益的作用[24],包括改善缺血/再灌注或缺氧/复氧诱导的组织损伤[25];改善肠系膜动脉的内皮功能障碍和血管松弛[26];通过降低胶原蛋白诱导的关节炎炎症因子水平起抗炎作用[27];通过抑制内质网应激改善果糖诱导的肝损伤[28]。目前尚不清楚肥胖相关的NAFLD是否也随着缺氧环境而改变,最近有研究表明,在中重度缺氧环境中降低了游离脂肪酸(Free fatty acid,FFA)的摄取和细胞内脂质的储存,是因为在缺氧条件下无法氧化FFA以及FFA转运蛋白的轻度减少(在严重缺氧中)[29]。几项动物研究表明[19,29,30],间歇性缺氧也会导致体重减轻。在一项针对23名患有代谢综合征的男性研究中发现[31],常压缺氧训练较常压常氧训练而言,对代谢性相关风险指标和身体健康等方面具有更好的反应。长期短暂反复暴露在缺氧环境中,缺氧-复氧的应急反应可造成机体损害,如阻塞性睡眠呼吸暂停[32]。因此,合适的氧气浓度和缺氧时间可以作为治疗肥胖相关代谢综合征的辅助治疗手段。本实验室摸索的长期短暂缺氧作为机体可耐受、简单可行的方法,可以改善肥胖和NAFLD[33]。
...............................
第2章材料与方法
2.1材料
2.1.1动物实验
实验中所用小鼠为购自长沙天勤生物有限公司的SPF级C57BL/6雄性小鼠。
2.1.2主要实验试剂

临床医学论文参考
..............................
2.2实验方法
2.2.1动物饲养条件及其饮食控制
2.2.1.1实验小鼠的饲养条件
使用C57BL/6的SPF级雄性小鼠,年龄为5周龄,体重约为20 g±2 g。将小鼠饲养在密闭的IVC环境标准笼中,光照12小时,黑暗12小时,小鼠可以随意进食和饮水。动物房的温度为23±2℃,湿度为40–50%,动物房的噪音控制在60 db以下。实验期间小鼠的各种行动均正常。
2.2.1.2构建小鼠非酒精性脂肪肝模型
(1)使用6-8周龄的野生型C57BL/6雄性小鼠构建非酒精性脂肪肝模型模型。(2)将小鼠随机分为4组:普通饮食组(Chow diet,CHD)、高脂饮食组(Highfat diet,HFD)、普通饮食低氧刺激组(CHD+10%O2)、高脂饮食低氧刺激组(HFD+10%O2)。(3)高脂饮食组和高脂饮食低氧刺激组用60%高脂饮食喂养小鼠12周,普通/高脂饮食低氧刺激组在常氧室温下10%氧气每天处理1小时,连续8周。高脂饮食喂养4周之后开始低氧刺激,并继续高脂饮食喂养至建模结束。
2.2.1.3实验小鼠的饮食控制
实验小鼠在IVC环境的动物房适应一周后(普通饮食喂养),高脂饮食组和高脂饮食低氧组的小鼠饮食由普通饮食变更为高脂饮食。于红荣微再(上海)生物工程技术有限公司购买高脂饲料。
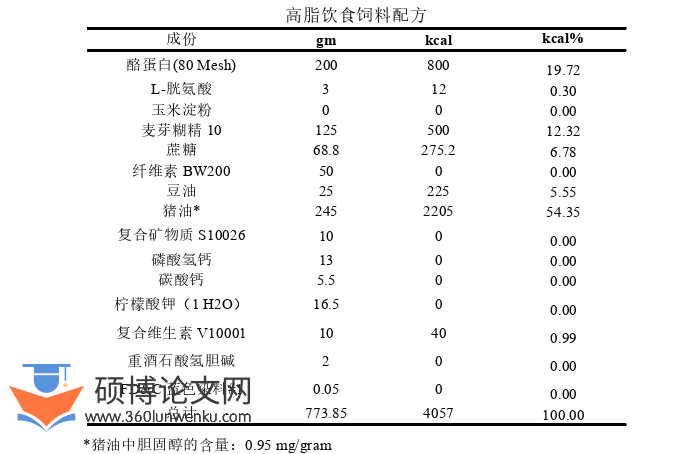
临床医学论文怎么写
..............................
第3章 实验结果 ................................ 16
3.1 动物造模及取肝脏组织进行组织测序分析 ................................ 16
3.2 长期短暂性低氧刺激缓解高脂饮食引起的小鼠体重和肝脏重量的增加 ...................... 16
3.3 长期短暂性低氧刺激缓解非酒精性脂肪性肝组织学改变 ........ 17
第4章 讨论.............................. 34
第5章 结论............................. 37
第4章讨论
本课题研究了长期短暂性低氧刺激对NAFLD的有益影响。与普通饮食相比,高脂饮食会引起肥胖和脂质代谢紊乱。通过比较常氧与长期短暂性低氧刺激下的肥胖小鼠肝脏组织转录组谱,与此同时,比较高脂饮食在常氧和长期短暂性低氧刺激下的肥胖小鼠肝脏组织蛋白组,我们发现长期短暂性低氧刺激下相关基因的差异表达,并揭示了胆固醇代谢转录调控的差异,提示长期短暂性低氧刺激能通过调控胆固醇代谢有效减轻肥胖引起的肝脏损伤。
肥胖是NAFLD最重要的致病因素之一。最近基于全球的荟萃分析显示,超过80%的NASH患者超重或肥胖[43]。高脂肪饮食导致体重增加,脂质代谢失调,TGs和FFA在肝脏组织中聚集。之前本课题组的研究表示[33],在长期短暂性低氧环境中会降低肥胖小鼠的体重,但其食物摄食量并未减少。一些研究表明,慢性缺氧可以改善果糖喂养的肥胖小鼠的脂质代谢[28]。这与本研究结果一致,与常氧条件下高脂饮食喂养的小鼠相比,在长期短暂性低氧刺激的条件下,高脂饮食喂养的小鼠体重、肝脏重量、脂滴数量、血清T-CHO和LDL-C、血清及肝脏的TGs和FFA水平均下降。值得注意的是,在高脂饮食喂养下血清中HDL-C的含量较普通饮食有所增加,在长期短暂性低氧刺激的条件下,进一步促进了HDL-C的水平。HDL-C被认为是促进胆固醇反向转运、降血脂的有益因素,一般认为肥胖小鼠的HDL-C含量会降低[44],而我们的结果与此相反。但是,也有研究报道高脂饮食增加肥胖C57BL/6小鼠的HDL-C水平[45,46],在肥胖昆明小鼠[47]、Ba LB/c[48]以及肥胖Sprague-Dawley大鼠[49]的HDL-C水平增高。综合上述,这些肥胖小鼠血清中HDL-C不同变化可能由多种因素造成,比如实验动物种属、实验室环境、测量脂蛋白的方法等,有待进一步澄清。
................................
第5章结论
我们采用本实验室建立的可耐受、简单易行的长期短暂性低氧方法,研究低氧改善高脂诱导的非酒精性脂肪肝,并探讨其机制。结果表明低氧提高CYP27A1、Angptl4等基因表达,改善胆固醇代谢,在缓解非酒精性脂肪肝中发挥重要功能。
参考文献(略)
