本文是一篇临床医学论文,本研究中,我们首先筛选出了67个与预后相关的IRGs,GO和KEGG分析显示这些基因主要富集的通路包括细胞因子活性、化学因子介导的信号通路、原发性免疫缺陷、JAK-STAT信号通路、Th17细胞分化等。
第2章材料与方法
2.1数据获取与预处理
登录TCGA数据库GDC界面(https://portal.gdc.cancer.gov)下载TCGA-BRCA项目中RNA-Seq的STAR-Counts数据及相应的临床数据和肿瘤突变数据。提取出所有样本mRNA的counts和TPM(Transcripts per million reads)格式的表达数据,counts格式数据仅用于最初的差异分析,后续分析皆使用log2(TPM+1)的数值。从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)获取原始数据集GSE20711和GSE42568,将两个数据集整合成一个GEO数据集,“sva”包用于去除不同数据集之间的批次效应。所有mRNA的表达谱数据均通过相应的R软件包进行了标准化处理。TCGA-BRCA队列中的肿瘤组织样本和正常对照被纳入免疫相关基因(Immune-related genes,IRGs)的差异表达分析,在随后的分析中,只考虑了TCGA-BRCA中的癌症组织样本,并排除了临床信息不够完整的样本,至少包括生存时间、生存状态、年龄和性别等。
从ImmPort数据库(http://www.immport.org/)中下载2483个IRGs[26]。在Molecular Signatures Database(MSigDB,www.gsea-msigdb.org)中获取200个标志性的缺氧相关基因(hypoxia-related genes,HRGs)。1184个上皮间质转化相关基因(EMT-related genes,EMTRGs)提取自dbEMT 2.0数据库(http://www.dbemt.bioinfo-minzhao.org/)[27]。
...............................
2.2数据分析
2.2.1 IRGs的差异表达分析和功能富集分析
将2483个IRGs与TCGA-BRCA、GSE20711和GSE42568队列的基因取交集,获取TCGA-BRCA队列的交集IRGs,使用R包“DESeq2”并根据|log2Foldchange(FC)|>1和发现错误率(False discovery rate,FDR)<0.05的筛选标准确定BRCA样本和正常组织样本之间的差异表达的IRGs。利用单因素Cox回归分析,识别出有预后价值的差异IRGs。使用"clusterProfiler"等包进行了京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)和基因本体(Gene ontology,GO)富集分析,以探索与预后相关的差异IRGs在BRCA中的潜在分子机制。
2.2.2共识聚类分析
将HRGs、EMTRGs分别与TCGA和GEO队列中的基因进行交叉,通过单因素Cox分析,发现17个HGRs和107个EMTRGs与BRCA患者的总生存期(Overall survival,OS)有关。使用R软件包“ConsensusClusterPlus”分别根据17个HRGs和107个EMTRGs的表达矩阵进行了共识聚类,以确定TCGA-BRCA队列中与缺氧、EMT相关的分子亚型。研究评估了聚类个数k=2-9之间的理想聚类数,并进行了1000次迭代以保证结果的稳定性。“limma”、“ggplot2”包用于主成分分析(Principal component analysis,PCA)及可视化。为了探索分子亚型和临床特征之间的关联,用Kaplan-Meier方法评估不同亚型之间的总生存率差异。“limma”、“org.Hs.eg.db”等R包被用于基因集富集分析(Gene Set EnrichmentAnalysis,GSEA)[28],FDR<0.05被认为具有统计学意义。为了研究不同亚型间生物过程的差异,用KEGG基因集(c2.cp.kegg.v7.5.1.symbols)进行基因集变异分析(Gene set variation analysis,GSVA)。接下来,利用“limma”包进行差异表达分析,阈值设置为logFC>1,FDR<0.05,识别出亚型间的差异表达基因,并通过火山图进行可视化。
.................................
第3章结果
3.1数据采集结果
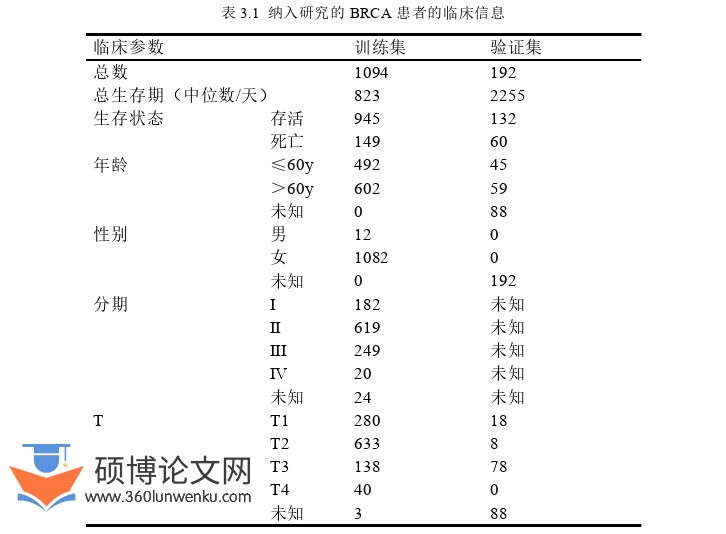
从TCGA数据库获取到了共1226个样本的转录组表达数据,其中包括1113个BRCA样本和113个正常组织样本。在癌症样本中,有1094例临床信息完整。将TCGA-BRCA队列中含完整临床数据的癌症样本数据作为训练集。GSE20711包含88个乳腺癌组织样本和2个正常对照,GSE42568包括17个正常组织样本和104个乳腺癌样本。GSE20711和GSE42568中的癌症样本均有完整的生存信息,合并两个GEO数据集并只保留BRCA样本作为验证集。两队列的临床数据见表3.1。
临床医学论文怎么写
.............................
3.2构建风险评分模型及相关分析
3.2.1差异表达的IRGs和功能富集分析
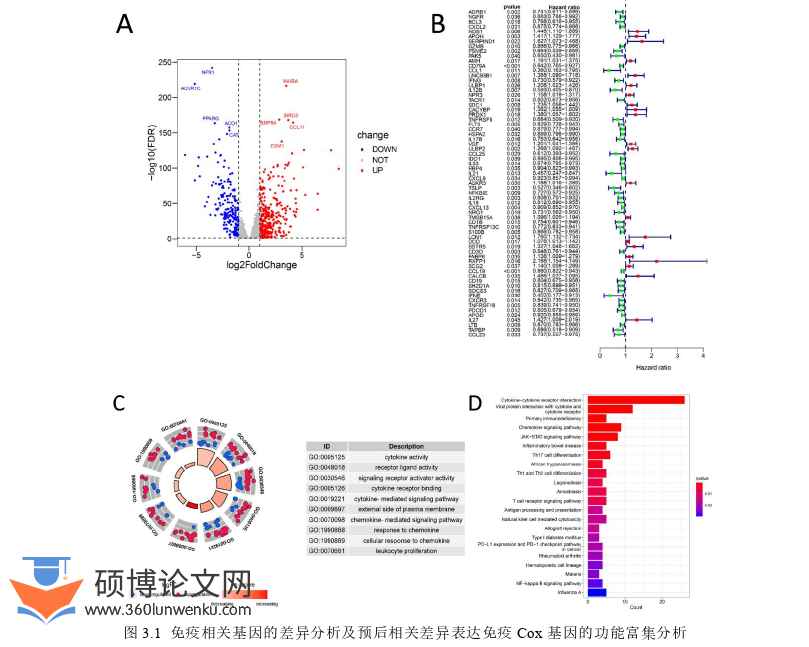
TCGA队列和GEO队列的基因与IRGs列表进行取交集后,得到了1250个交集IRGs,对肿瘤和正常样本进行差异分析后得到512个差异表达IRGs,其中312个在癌症组织中上调,200个下调。通过火山图可视化并在图中展示了上调和下调最显著的前5个基因(图3.1A)。通过单因素Cox回归分析确定差异IRGs与OS的相关性,筛选出67个对BRCA有预后价值的差异IRGs(图3.1B,p<0.05)。接着,我们进行了与预后相关的IRGs的功能富集分析,GO分析显示这些差异基因主要分布在细胞因子活性、受体配体活性、质膜外侧、细胞因子介导的信号通路、对化学因子的反应、白细胞增殖等(图3.1C)。KEGG通路主要富集在病毒蛋白与细胞因子和细胞因子受体的相互作用、原发性免疫缺陷、JAK-STAT信号通路、炎症性肠病、Th17细胞分化、Th1和Th2细胞分化等(图3.1D)。
临床医学论文参考
..........................
第3章 结果..................................... 7
3.1 数据采集结果 ....................................... 7
3.2 构建风险评分模型及相关分析 ................................... 8
第4章 讨论............................... 22
第5章 结论.............................. 25
第4章讨论
免疫微环境、缺氧和EMT在乳腺癌的进展和转移中起着重要作用。缺氧增加肿瘤的侵略性、转移的风险、对放疗和化疗的抵抗力,并诱发肿瘤免疫抑制[29]。乳腺癌中大约25-40%的区域存在缺氧,并且缺氧对乳腺癌患者的生存有负面影响[30]。缺氧也可以促进BRCA患者的EMT[29]。近年来,研究报道EMT与BRCA肿瘤侵袭,转移、内分泌治疗和化疗耐药、癌细胞干性特征和不良预后相关[29,31–34]。缺氧和EMT可以改变肿瘤免疫微环境,导致肿瘤免疫抑制和免疫逃逸[20,21,35]。肿瘤免疫微环境中的免疫浸润与癌症发展有关并对预测BRCA的预后起着决定性作用[36,37]。因此,免疫、缺氧和EMT相关基因可能是预测BRCA患者预后的有效特征。构建预后风险模型是评估预后性能的一个常见策略。鉴于免疫、缺氧和EMT之间的密切联系,我们旨在建立一个基于多种基因特征整合的新型预后模型。
本研究中,我们首先筛选出了67个与预后相关的IRGs,GO和KEGG分析显示这些基因主要富集的通路包括细胞因子活性、化学因子介导的信号通路、原发性免疫缺陷、JAK-STAT信号通路、Th17细胞分化等。然后,通过共识聚类确定了两种缺氧亚型和两种EMT亚型。K-M曲线显示在两种表型的亚型之间均存在明显生存差异。GSEA分析显示,缺氧相关基因集在预后较差的的亚型中被明显富集,说明高缺氧状态与不良预后相关。同样,EMT相关基因集也显著富集在预后较差的亚型中,说明预后不佳的亚型拥有高EMT状态。这与以前的研究结果一致,缺氧可导致乳腺癌预后不良[38],EMT与乳腺癌的不良临床结果相关[32]。接下来,获取亚型之间差异表达的缺氧和EMT相关基因。在此基础上,我们构建了一个结合免疫相关缺氧和EMT基因的新型预后风险模型。根据风险评分将BRCA患者划分为高、低风险组,生存分析及ROC曲线表明,所构建的风险模型在训练集和验证集中对预测BRCA患者的生存表现出了可靠的能力。此外,单因素和多因素Cox分析结果表明构建的模型是BRCA患者生存结果的一个独立预测因素。我们还结合临床特征和风险评分开发了一个列线图用于预测BRCA患者的生存率,C指数(0.783)和5年AUC(0.765)表明该列线图的预测性能良好。
.............................
第5章结论
本研究基于免疫、缺氧和EMT相关基因成功地构建了一个预后风险评分模型,可以帮助BRCA患者的风险分层并指导治疗。我们发现该模型与肿瘤免疫微环境密切相关,并且可以作为BRCA患者的独立预后标志。
参考文献(略)
