第一章 绪论
1.1 骨缺损修复的研究现状
骨缺损是外科中常见的问题,通常由外伤、肿瘤和感染引起。骨组织是一种动态的且高度专一的结缔组织形式[1],由于其独特的再生能力贯穿人的一生,这一过程称之为骨重塑,因此其具有较高的再生能力[2, 3]。相同于口腔内骨缺损也具备一定的自我再生能力,但其骨重塑可能需要几个月到几年的时间,并且表现出明确的个体差异。尤其是在下颌骨中,由于较差的创面稳定性进而导致其无法完全愈合[4],因此,迫切需要有效的骨增量手术。骨增量是在解剖或功能缺陷区域增加骨组织的过程。例如上颌窦提升,位点保存或牙槽嵴增,在该过程中新形成的骨组织的目的是为将来的种植体提供稳定和支持。随着天然骨的生长,其替代移植材料,并随着时间的流逝,形成新骨[5],新形成的骨组织可通过骨诱导或骨传导生长。骨诱导是指天然骨中未分化的间充质细胞被诱导为成骨细胞或成软骨细胞,并诱导周围组织生长出新骨,这通常取决于骨形态发生蛋白(BMP);骨传导为通过支架促进已经存在的骨组织或分化的间充质细胞形成骨组织的物质[6]。当前有几种方法可应用于治疗骨缺损。其中最为常用的方法是自体骨移植,并被认为是骨缺损移植的金标准,自体骨移植物可以从患者的下颌支或颏部或其他部位获得,选择的供体部位取决于所需移植物的体积。多数情况下,自体骨移植是首选的手术方法,因为其提供了促进骨修复的所有必要因素,即骨诱导生长因子、骨传导胶原支架基质和成骨干细胞。自体骨可通过三个阶段愈合,第一个阶段是成骨作用,在这个阶段生存下来的细胞形成了类骨质。在移植 2 周后开始第二阶段的骨诱导,来自缺损部位骨组织内的血管侵入移植物中,天然细胞跟随血管进入骨移植物中并且此阶段是由 BMP 所介导的。第三个阶段发生时,需要来自骨移植物的物质不影响天然骨组织的爬行及生长[6, 7],这三个阶段是相互重叠的。该种方法不具有疾病传播或免疫原性的风险[8, 9]被应用较多。但开发第二术区、供体有限及相关的发病率是自体骨移植的无法避免的缺点[10][11, 12]。相反,同种异体移植材料是来自同一物种的另一个个体(通常是尸体)的骨材料。将骨材料灭菌,特殊处理并存储在骨库中。同种异体移植物可通过骨诱导起作用,并且对天然未分化的间充质细胞也具有骨传导能力。
........................
1.2 骨髓间充质干细胞(bone marrow mesenchymal stem cells)的研究
大约 130 年前,德国病理学家 Cohneim 首次提出了在骨髓中存在非造血干细胞(HSC,Non-hematopoietic stem cells),提出骨髓可以是成纤维细胞的来源,有助于周围许多组织的愈合[25]。在 1970 年代 Friedenstein 等人的工作,证明啮齿动物的骨髓中有成纤维细胞,可在体外在塑料上形成菌落,因此被称为菌落形成单位成纤维细胞集落形成单位(CFU-Fs)。引起学者们注意的是在皮下移植中,这些细胞既能够形成骨骼又能够重建造血微环境[26]。于是 Castro 于 1980 年成功从人骨髓中分离出 CFU-F,并表明这些细胞可以在体外亚传代并可分化为多种间充质谱系,例如成骨细胞,软骨细胞和脂肪细胞[27, 28]。此外,Pittenger 等在 1999年也明确,单个 MSC 克隆确实具有多能性,因为它们可以在体外为多个间充质谱系提供源头。Friedenstein 将此种细胞从骨髓中分离出来,后来 Caplan 将其重命名为“间充质干细胞”(MSC)[29][30, 31]。
1.2.1 BMSCs 的体外分离
学者们提出从人骨髓中获得 BMSCs 有四种方法:1)全骨髓贴壁法,将获取的不做任何处理的骨髓组织在完全培养基中培养,并定期更换培养基,根据BMSCs 贴壁特性将不贴壁的细胞逐渐清除;2)密度梯度离心法,采取离心将骨髓中各类细胞比重不同进行分离;3)免疫磁珠分离法,此种方法通过利用免疫磁珠将 BMSCs 表面带有或缺失的抗原成分进行分离,该种方法纯度最高但价格昂贵;4)流式细胞仪分选法。
1.2.2 BMSCs 的表面特征及鉴定
通过缺乏 CD34、CD45、CD14 和 HLA-DR 以及表达 CD29、CD44、CD90、HLA-ABC 和 UEA-1[30, 32],表面 CD 标记物常被用于区分 BMSCs 和造血细胞。这些细胞可以在体外分化形成具有脂肪、软骨和骨细胞特征的细胞,例如,可通过茜素红 S 染色电镜下观察钙结节染色结果鉴定其成骨分化潜能;利用油红 O染色观察脂滴鉴定其成脂潜能;以及利用阿尔新蓝染色确定成软骨能力。
.............................
第二章 BMSCs 分离培养与鉴定
2.1 材料及方法
2.1.1材料
表 2.1 实验试剂
2.2实验结果
2.2.1BMSCs 形态观察
获得的骨髓组织置于 6 孔板中培养 7-14 天后,镜下观察到长梭状或多角形贴壁细胞从组织中爬出(图 2-1a)。细胞贴壁后快速增殖很快长满培养板底部。细胞长满后传代细胞呈长梭状(图 2-1b),并在短时间内细胞即铺满整个培养瓶(图 2-1c,图 2-1d)。
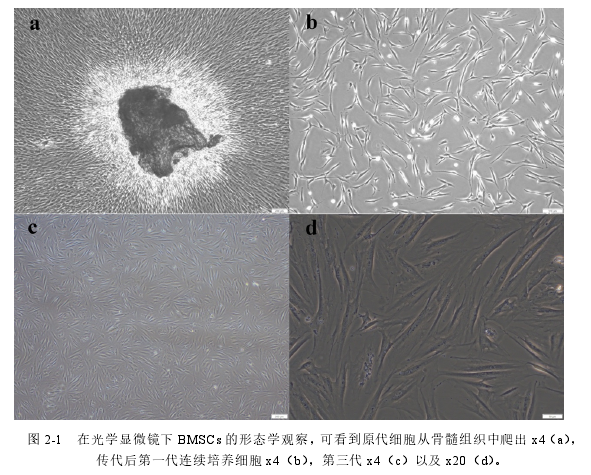
图 2-1 光学显微镜下 BMSCs 的形态
第三章 i-PRF 的制取与结构分析 .................................. 16
3.1 引言 ................................................ 16
3.2 实验材料及方法 ........................................ 16
3.2.1 材料 ............................................ 16
3.2.2 方法 .................................. 17
第四章 i-PRF 对 BMSCs 的生物学行为的影响 ................................. 22
4.1 引言 ........................................ 22
4.2 实验材料与方法 ................................... 22
4.2.1 仪器设备及试剂 ............................................ 22
4.2.2 方法 ...................................... 23
第五章 i-PRF 通过上调 ERK1/2 和 PLCγ1 促进 BMSCs 成骨分化...............33
5.1 引言 .......................................... 33
5.2 实验材料与方法 ......................... 33
第五章 i-PRF 通过上调 ERK1/2 和 PLCγ1 促进 BMSCs 成骨分化
5.1 引言
当 i-PRF 接触细胞后,受到微环境的影响后,某些相关的信号通路会被激活从而调整细胞的生物学行为包括增殖、定向分化等[100]。其中 ERK1/2 和 PLCγ1通路包含在是其成骨分化调控通路中。ERK1/2 是有丝分裂活化的蛋白激酶的途径之一,该途径通过磷酸化 ERK1/2 活化成骨细胞的 Runx2[58],以及其下游基因OSX(Osterix)表达调控细胞成骨。不仅如此,Syk 通路在破骨细胞的成熟和骨吸收中至关重要,该信号在通过调节 PLCγ 活性来调节 BMSC 的成脂和成骨分化的初始阶段具有双重作用,生长因子受体结合蛋白 2(Grb2)参与成骨分化的Syk-PLCγ1 轴,发现调节 PLCγ1 的活性可影响 BMSC 细胞系分化的早期阶段。
之前的研究表明,i-PRF 具有正向调节 BMSCs 成骨分化的作用,但其中机制尚未明朗,ERK1/2 通路以及 PLCγ 通路是否参与该过程尚未大量报道。我们猜测,该两种通路可参与到 BMSCs 成骨分化过程中,因此,本实验对 ERK1/2以及 PLCγ 通路在 i-PRF 在 BMSCs 成骨分化的关系进行研究。
表 5.1 实验仪器及设备
............................
第六章 总论与展望
近年来,为了提高种植学领域中各种骨缺损治疗方式,在口腔中使用再生方式逐渐变得越来越重要。利用血小板浓缩物以促进再生丢失的组织就包含有i-PRF。本研究的发现表明,通过短而慢速的离心程序(i-PRF 程序),从上层血浆层获得的液体富血小板纤维蛋白通过 SEM 以及人生长因子阵列膜检测获得该类血液制品的微观结构和分子组成。以及其对来自种植窝洞的人骨髓间充质干细胞的增殖、迁移的影响并探讨在骨髓间充质干细胞成骨分化的作用及其机制。 主要结论:
1. 通过全骨髓贴壁法获得人骨髓间充质干细胞,并经过表面标志物鉴定、成骨和成脂分化检测,成功获得大量人骨髓间充质干细胞。
2. 通过 SEM 以及人生长因子阵列膜证明 i-PRF 是一种具有三维网络结构内含有大量血小板和白细胞的三维立体结构。并且能释放大量促进软硬组织愈合、再生的生长因子。
3. i-PRF 在体外对 BMSCs 的增殖、迁移有显著促进作用,当诱导条件存在下,i-PRF 可显著增强其成骨能力,单独使用时有一定诱导成骨分化能力。
4 i-PRF 可通过 ERK1/2 通路正向调控 BMSCs 的成骨分化以及促进 PLCγ1的表达。
参考文献(略)
