本文是一篇临床医学论文,本实验通过研究传统的降糖药物对脓毒症大鼠肺脏的影响,是本实验的创新点之一,属于老药新用。并且证实了Met通过AMPK途径途径发挥重要作用,为今后的临床药物靶点研发提供理论依据。
1 脓毒症所致ALI/ARDS发病机制
1.1 炎症反应失调
临床医学论文怎么写
炎症反应失衡在ARDS的发病机制中起到重要作用,巨噬细胞、中性粒细胞等免疫细胞在受到刺激时可以释放炎症细胞因子,使肺组织内皮细胞和上皮细胞损伤引起通透性增加,肺脏因此发生弥漫性的肺泡水肿,基底上皮细胞的透明膜形成[35]。ARDS早期组织学显示肺内中性粒细胞聚集,中性粒细胞与内皮细胞表面粘附分子相互作用引起中性粒细胞聚集[36],中性粒细胞变形能力减弱也可以引起其聚集。通常中性粒细胞要通过变形通过肺微血管[37],很多细胞因子及趋化因子包括补体5a(complement component 5a, C5a)、白三烯B4(Leukotriene B4, LTB4)、白介素-8(interleukin8, IL-8)和内毒素对其变形会产生一定抑制作用,使其更难通过毛细血管床[38]。中性粒细胞经活化可以产生多种细胞毒性物质,如前炎性细胞因子、活性氧等[39, 40],增加中性粒细胞炎症反应时间可进一步加重肺脏损伤[41]。肺泡巨噬细胞在肺部抵抗外部干扰方面发挥重要的作用,是呼吸道防御体系的一道重要防线。不过研究发现在这种防御体系异常情况下,也会导致机体损伤,肺泡巨噬细胞再激活后可以释放出很多促炎因子及趋化因子,中性粒细胞通过趋化因子大量聚集到损伤部位,这样也导致相应的炎性损伤进一步加重,进而导致炎性级联反应和不同程度的肺部损伤[42]。巨噬细胞对内毒素刺激的重要调节因子是巨噬细胞迁移抑制因子,其通过调控toll样受体4(toll-like receptor 4, TLR4)的表达以及抑癌蛋白p53的生物学活性来调节巨噬细胞的功能[43]。
炎症反应与抗炎反应的失衡在脓毒症所致ARDS的发病机制中起主导作用。脓毒症ARDS发病过程中促炎细胞因子包括IL-1β、IL-6、IL-8、IL-12、TNF-α、高迁移率族蛋白B1(high mobility group protein B1, HMGB1)、γ-干扰素(interferon-γ, IFN-γ)等,抗炎细胞因子包括IL-4、IL-10、IL-13、细胞集落刺激因子(colony stimulating factor, CSF)、转化生长因子-β(transforming growth factor-β, TGF-β)等[44]。
...........................
1.2 氧化应激
氧化应激是自由基产生和清除之间的平衡被破坏,导致机体应激损伤的一种状态。氧化剂通过修饰改变细胞内脂质、蛋白质和DNA导致它们的功能发生异常。为了中和氧化剂对机体造成的影响,肺脏中同时存在大量的抗氧化物质,维持机体氧化还原状态的平衡,机体氧化剂大量产生,还原剂便不堪重负,机体的组织损伤随即便会发生[61]。相关实验研究发现肺内皮细胞、肺泡巨噬细胞等在炎症等刺激作用下都可以释放出大量的活性氧(reactive oxygen species, ROS),进而导致氧化应激[62]。ROS是氧化剂主要的组成成分,在细菌、血小板活化因子(platelet activating factor, PAF)及脂多糖(lipopoly saccharide, LPS)等有害刺激作用下,单核-巨噬细胞、中性粒细胞被激活,进而释放出大量的氧化剂。ARDS治疗时一般需要保持较高浓度的吸氧,这也和活性氧的来源密切相关[63]。在ALI动物模型中的研究结果表明,中性粒细胞产生ROS与肺损伤存在密切关系[64]。ROS可对内皮细胞起到一定破坏作用,引发相关的损伤[65]。在炎症细胞激活后可以产生ROS,ROS还可作为一种趋化因子诱使中性粒细胞的迁移从而粘附聚集,正反馈刺激加速中性粒细胞的活化,参与肺部炎症及氧化应激损伤的发生[66]。氧化应激过程和多种疾病的病理过程都存在相关性。ALI时肺内ROS持续产生并积累,可以引起肺脏氧化应激损伤进行性加重[67]。肺组织和上皮层中有大量的抗氧化剂,可对氧化应激起到一定的抑制作用。相关研究发现机体中的抗氧化剂有很多种,主要包括维生素C、谷胱甘肽过氧化物酶、硫醇、超氧化物歧化酶(superoxide dismu tase, SOD)、过氧化氢酶等,可以不同程度的起到清除ROS的作用。抗氧化剂可以对ALI/ARDS动物模型发挥肺脏的保护作用[68-70]。SOD为机体内重要的抗氧化剂,在氧化应激及炎症调节中起着重要的作用。细胞间粘附分子-1、肺组织髓过氧化物酶、血管细胞粘附分子-1的表达增高,SOD活性下降使脓毒症继发急性肺损伤的可能性大幅度提高[71]。SOD也可以降低机体氧化应激及炎症反应引发的损伤。在判断脓毒症病情方面有重要的意义,监测患者血清中SOD的表达水平可以为相关诊治提供支持和指导。核因子E2相关因子2(nuclear factor erythroid-derived 2 like 2, Nrf2)作为一种抗炎、抗氧化的信号通路,在细胞的防御与保护中起重要作用[72, 73]。研究发现,肺部的低氧环境激活氧化还原敏感性核因子- κB(Nuclear factor kappa-B, NF- κB),大量的促炎细胞因子和趋化因子释放出,这也会加重氧化应激损伤。炎症反应与氧化应激互为协同使得ARDS恶化[74]。
...............................
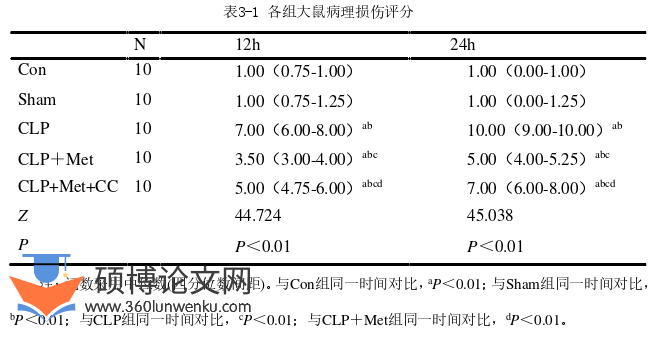
结果
1 大鼠一般状态观察
Con组大鼠饮食正常、反应灵敏活跃、双眼无分泌物、体毛光泽无竖毛、无腹胀、体温正常、大便成颗粒状。Sham于麻醉后3 h完全苏醒,一般状态与Con组无区别,大鼠反应活跃、进食正常、体温正常、一般状态良好。Con组与Sham组开腹后观察腹腔内肠管表现正常、肠管无水肿及扩张、无臭味、无腹水、腹腔脏器无粘连等情况。CLP组造模后,大鼠出现体温降低、呼吸急促、活动减少、弓背蜷缩于一角、竖毛、进食减少、眼周有分泌物、腹胀明显、稀水便。开腹立即出现刺鼻恶臭气味、肠管扩张明显、肠道严重水肿、色泽变暗一部分肠管出现了坏死、腹腔脏器出现广泛粘连、大量血性腹水等表现。CLP+Met组大鼠相对于CLP组则明显表现活跃,体温有所上升、呼吸较平缓、进食量增加、腹泻症状缓解。开腹后肠道改变明显减轻,血水量减少、轻度水肿扩张、脏器黏连不明显。而CLP+Met+CC组与CLP+Met组比较大鼠一般状态变差,开腹后肠道改变也加重。Con组、Sham组在12 h、24 h内一般状态无明显变化,12 h、24 h开腹后无臭味、肠道颜色正常、无扩张、粘连等。CLP组、CLP+Met组、CLP+Met+CC组随着时间的进展大鼠的一般状态均变差,在24 h打开腹腔后相较于12 h打开腹腔,各组腹水更多、肠管扩张更为明显、肠道充血更严重。
...........................
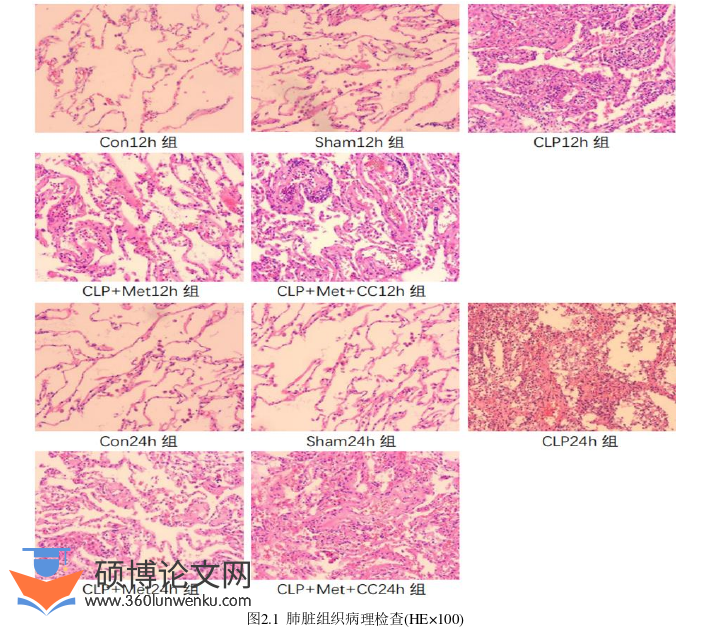
2 大鼠肺脏组织病理改变
Con组:肺泡结构完整排列规则,腔内未见明显异常分泌物,肺泡腔饱满,肺泡上皮细胞形态分化良好,肺泡间隔毛细血管丰富,间隔厚薄均一,未见急慢性炎细胞浸润。
Sham组:在肺泡结构、腔内分泌物、炎症细胞浸润、肺泡间隔厚度等方面与Con无明显区别。
CLP组:肺组织结构紊乱,肺泡结构基本消失,仅残存少量挤压变形肺泡腔,肺泡上皮细胞增生,腔内见部分渗出物,肺泡间隔显著增宽,间杂大量中性粒细胞及淋巴细胞等急慢性炎性细胞浸润,局部亦可见出血。
CLP+Met组:肺组织整体结构基本完整,部分稍紊乱,肺泡结构可见,肺泡腔结构稍不规则,局部肺泡间隔轻度增厚,间杂毛细血管轻度扩张,伴少量炎性细胞浸润,整体形态较前明显好转。
CLP+Met+CC组:肺组织结构排列总体较为紊乱,但肺泡结构尚可辨认,肺泡腔挤压变形,大小不一,腔内部分可见渗出物,肺泡上皮细胞可见增生,肺泡隔伴增厚,间杂毛细血管扩张伴充血,间杂可见部分中性粒细胞及淋巴细胞等炎性细胞浸润。
在12 h、24 h时间点上Con组、Sham组病理改变无区别。24 h时间点的CLP组、CLP+Met组、CLP+Met+CC组分别比12 h截点的CLP组、CLP+Met组、CLP+Met+CC组的肺泡结构完整性、肺泡充血、炎性细胞浸润、肺泡间隔厚度等的病理损伤较重。见图2.1。
临床医学论文参考
.............................
六、结果....................28
七、讨论..........................41
八、结论......................46
讨论
脓毒症的发生发展过程是重症医学领域急需解决的问题,虽然近年来对脓毒症的研究在不断深入,然而由于脓毒症的发病机制复杂,涉及全身各个器官的受损,造成多器官的衰竭,死亡率一直居高不下。随着脏器支持技术的迅猛发展,尤其是体外膜肺(extracorporeal membrane oxygenation, ECMO)技术的应用改善了脓毒症相关肺损伤患者的预后。肺脏作为脓毒症受损的主要靶器官,找到脓毒症肺损伤的发病机制,根据发病机制研发相应治疗药物,成为研究重点[8-10]。通过阅读大量文献总结脓毒症相关ALI/ARDS的发病机制涉及炎症反应失衡、氧化应激、细胞凋亡、内皮损伤、表面活性物质减少、凝血机制异常及肠道屏障功能减弱等。AMPK作为能量调控开关,通过参与上述机制调控脓毒症的发生与发展[24]。找到AMPK激动剂,并探索AMPK的激动是否调节脓毒症相关肺损伤成为本课题研究设计的思路。Met作为传统的降糖药物,近年来在多个学科的不同疾病发现了其新的用途,大量研究表明Met发挥各种作用机制是通过激活AMPK实现的[117]。然而Met对脓毒症所致ALI/ARDS的研究相对较少,肺脏作为脓毒症受损的器官,炎症反应在脓毒症肺脏损伤的发病机制中发挥着重要作用,Met被证实在炎症反应中发挥调控作用[118],因此提出课题《二甲双胍对脓毒症大鼠肺脏的炎性保护与AMPK通路的相关性研究》。
.................................
结论
1.Met可以发挥对脓毒症大鼠肺脏的保护作用,这种保护作用是通过抑制肺脏的炎症反应实现的。
2.Met抑制脓毒症大鼠肺脏的炎症反应是通过激活AMPK信号通路实现的,并可以被CC所阻断。
参考文献(略)
