第一章 引言
1.1 舌鳞状细胞癌
1.1.1 舌鳞状细胞癌简介
口腔癌在全身恶性肿瘤中较为常见,约占 2%,是最常见的恶性肿瘤之一[1],舌鳞状细胞癌(tongue squamous cell carcinoma, TSCC)是口腔中最常被诊断出来的癌症,约占口腔癌发病率的 50.5%,常常表现为局部浸润,快速生长和明显的疼痛[2]。近年来的研究表明,全球舌鳞状细胞癌的发病率逐年上升[3],尤其在年轻人发病率逐渐提高[4]。TSCC 多见于舌缘,其次为舌腹、舌背、舌尖,与吸烟,酗酒,咀嚼烟草,慢性伤害和口腔卫生差等因素密切相关[5]。TSCC 极易发生早期淋巴结转移,转移率较高,且易复发,因此导致 5 年生存率较低,仅有 55%[6,7]。舌鳞状细胞癌生长方式为向周围组织浸润,肿瘤中血管非常丰富,生长过程中能产生多种促进血管生成的因子,促进了肿瘤的侵袭和转移[8]。血管生成在TSCC 的发生发展中起着重要作用[9]。在肿瘤转移、侵袭和复发过程中新血管形成也起着重要作用[10],血管生成是与多种类型癌症预后相关的肿瘤转移的新型重要介质,包括口腔鳞状细胞癌[11]和 NSCLC[12]。
1.1.2 舌鳞状细胞癌的治疗现状
舌的解剖部位较为特殊,其不仅能维持患者颌面部的美观,同时在语言、吞咽等重要生理功能过程中发挥重要作用。因此临床上需要选择合适的治疗方法治疗 TSCC,而患者对手术结果产生的生理和心理方面的影响也不容忽视。舌的淋巴回流极其丰富,从 TSCC 癌前病变到浸润性恶性肿瘤进展较快,且缺乏明确的判断指标,无法及时诊断,导致患者预后不良[13]。舌鳞状细胞癌的生长、侵袭和转移都以其血管生成为基础,由于舌鳞状细胞癌和正常细胞产生的正负血管生成因子之间不平衡,导致新生血管形成,这些新形成的血管促进 TSCC 生长,提高TSCC 细胞的侵袭转移能力[14, 15]。目前手术治疗仍是临床上最常用的治疗舌鳞状细胞癌的手段,近年来放化疗及靶向治疗逐渐成为综合治疗模式中主要的辅助治疗手段[16, 17]。患者在舌鳞状细胞癌早期阶段,可以通过手术将原发灶切除,对临床检查发现没有淋巴结转移的,需行选择性颈淋巴清扫术,晚期除切除原发灶外,必要时需行根治性颈淋巴清扫[18]。舌周围分布有大量的淋巴系统,淋巴结转移和疾病阶段与治疗结果相关。尽管肿瘤分期转移(TNM)是一个容易使用的指标,但由于一些肿瘤属于同一临床阶段,有些肿瘤患者可能会表现出完全不同的结果,因此临床分期系统在预测 TSSC 的预后方面会遇到困难[7]。
............................
1.2 肿瘤发生与血管生成的关系
恶性肿瘤需要营养和氧气才能生存和增殖,因此需要生长于血管附近,以进入血液循环系统。肿瘤中新生血管越多,肿瘤的恶性程度越高。肿瘤细胞生长,侵袭和转移通过血管生成得以实现。另外,血管生成因子存在肿瘤微环境中,内皮细胞经其诱导后发生增殖形成新的肿瘤血管[23, 24]。浸润性生长的肿瘤细胞可以通过血管模拟的过程形成血管样结构。这些没有涉及内皮细胞而形成的结构形成肿瘤细胞获得充足血液供应和营养的替代渠道。此外,肿瘤的新血管形成也会影响肿瘤的微环境。肿瘤细胞可从原发位置沿全身血管转移,并在适当的位置生长形成新的肿瘤[25]。已在许多肿瘤类型中观察到血管拟态,包括神经胶质瘤[26],头颈癌[27],肺癌[28]和结直肠癌[29]。葡萄膜黑色素瘤中参与血管拟态的肿瘤细胞具有多能干细胞样表型并表达 CD271[30]。黑色素瘤基质中同时存在血管拟态和纤维血管间隔,并可以通过其厚度和分层来区分[31]。血管拟态可以通过多种方式促进肿瘤进展。在黑色素瘤中,线粒体活性氧会在缺氧条件下诱导 Met 原癌基因的活化,从而促进血管拟态,导致肿瘤细胞运动,侵袭和转移[32]。据报道在神经胶质瘤中,抗血管生成治疗后血管拟态增加[33]。在一些研究中,观察到肿瘤内皮细胞具有与肿瘤恶性细胞相似的体细胞突变,表明肿瘤内皮细胞是肿瘤起源[26,34]。通过在促进内皮细胞的培养基中培养神经胶质瘤癌干细胞,证明了神经胶质瘤细胞向内皮细胞的转化,导致泛内皮标记物 CD31,CD34 和 vWF 的表达,肾小管结构的形成和 LDL 的吸收[26,35]。
..........................
第二章 体外实验研究 ZMIZ1 基因对舌鳞状细胞癌血管生成的影响
2.1 试剂及仪器
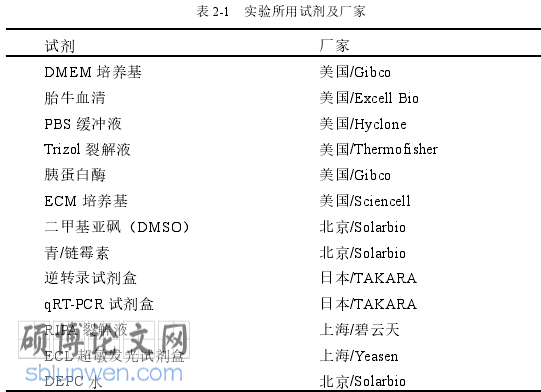
2.1.1 试剂及试剂盒
血管生成在舌鳞状细胞癌的发生发展中起着重要作用,舌鳞状细胞癌的生长、侵袭和转移都以其血管生成为基础。血管生成是新血管形成的过程,由于舌鳞状细胞癌和正常细胞产生的正负血管生成因子之间不平衡,导致新生血管形成,这些新形成的血管促进肿瘤生长,增加肿瘤细胞分化的损失,并且提高肿瘤细胞的侵袭能力[14, 15],根据血管生成与肿瘤进展和转移的关系,寻找靶向舌鳞状细胞癌血管生成的新型生物标志物至关重要。本章通过构建敲减 ZMIZ1 基因的稳定转染舌鳞状细胞癌细胞株,应用 CCK-8 实验、Transwell 小室实验和小管生成实验检测敲减 ZMIZ1 基因的舌鳞状细胞癌细胞对人脐静脉血管内皮细胞(HUVEC)细胞的影响。
临床医学论文怎么写
2.2 实验方法
2.2.1 细胞复苏
从液氮罐中分别夹取 CAL-27 细胞和 DOK 细胞冻存管,迅速转运至 37℃水浴锅中,待其完全溶解后以 1000 r/ min 离心 5 min,在超净工作台内弃去原有冻存液,加入完全培养基,使用移液枪轻轻吹打混匀后将复苏的细胞转移至 25 cm2细胞培养瓶中,加入 3 mL 完全培养基(90%DMEM+10%胎牛血清),放入细胞孵箱(37℃,5% CO2)中培养。
2.2.2 细胞培养
隔天将培养瓶从细胞孵箱中取出,显微镜下观察细胞形态及贴壁数量,弃去原培养基,PBS 清洗 2 遍,加入 3 mL 完全培养基后置于细胞孵箱中培养,每 2~3d 对细胞进行换液。
2.2.3 细胞传代
细胞汇合度达到 85%-90%时对细胞进行传代。弃去原培养基,PBS 清洗,加入 700 μL 胰蛋白酶对细胞进行消化,显微镜下观察到细胞之间出现间隙,终止消化,将瓶底的细胞吹打下来,混匀后将细胞悬液 1000 r/ min,离心 5 min。加入完全培养基,吹打形成单细胞悬液,显微镜下进行细胞计数,根据所需细胞数量进行传代。
2.2.4 细胞冻存
细胞消化步骤同上,将细胞悬液离心后,弃除培养基,细胞冻存液现用现配,与细胞混匀后分装至冻存管中,封口。标记后放入梯度冻存盒中,-80℃冰箱过夜,第二天放入液氮罐中用于长期储存细胞。
2.2.5 Western blot 检测 ZMIZ1 蛋白在 CAL-27 细胞和 DOK 细胞中的表达
(1)提取总蛋白
选取生长状态良好且汇合度达到 80%-90%的细胞,PBS 洗 3 遍,将 500 μL裂解液按 RIPA:PMSF=100:1 的比例加入细胞瓶,轻晃混匀,充分反应后刮下细胞,加入到 1.5 mL 离心管中,4℃ 12000 r/ min 离心 15 min,吸出上层无色透明液体,吸取 60 μL 进行 BCA 蛋白定量,剩余液体加入一新的 1.5 mL EP 管,按照体积比例加入 4×loading buffer,置于 95℃水浴锅中 5 min,冷水中 1 min,重复 3 次。将变性的蛋白分装,储存在-80℃冰箱备用。按照说明书稀释 BSA,将稀释后的样品加入到 96 孔板中,孵育 30 min 后测定 OD 值,绘制标准曲线。将用于蛋白定量的蛋白质 20 μL 加入到 200 μL 工作液中,将测定的 OD 值代入标准曲线,得到每组的上样量。
..........................
第三章 体内实验研究 ZMIZ1 基因对舌鳞状细胞癌血管生成的影响....................22
3.1 试剂及仪器.......................................... 22
3.1.1 试剂及试剂盒...................................22
3.1.2 仪器设备..................................23
第四章 ZMIZ1 基因影响舌鳞状细胞癌血管生成的机制...................35
4. 1 试剂及仪器.............................................35
4.1.1 试剂及试剂盒...................................35
4.1.2 仪器设备............................35
全文总结...............................43
第四章 ZMIZ1 基因影响舌鳞状细胞癌血管生成的机制
4. 1 试剂及仪器
4.1.1 试剂及试剂盒
肿瘤血管通常功能失调,助长了癌症的进展。当前的血管靶向策略是基于对已知促进肿瘤血管生成的关键血管生成信号通路的抑制[24]。为了控制肿瘤中血管生成反应,探索 TSCC 治疗的新型诊断和预后生物标记物,有效靶向 TSCC,提高患者的生存质量,是近年来研究的热点。前期的实验结果表明敲减 ZMIZ1 基因在体内和体外均可抑制 TSCC 的血管生成,但 ZMIZ1 影响 TSCC 血管生成的机制尚不清楚。PI3K/AKT 通路在多种肿瘤中均失调,与血管生成过程密切相关[57]。本部分检测了敲减 ZMIZ1 基因后,VEGF 及 PI3K/AKT 通路相关因子在体内和体外的表达情况,探讨 ZMIZ1 基因影响 TSCC 血管生成的机制。

临床医学论文参考
...................................
全文总结
舌鳞状细胞癌(TSCC)是最常见的口腔癌类型,表现出高恶性,无限制生长和活跃的组织浸润等特征,导致患者存在咀嚼、言语和脱发等功能障碍[166]。阐明 TSCC 形成和发生发展的机制,有助于确定 TSCC 治疗的潜在靶标。本研究使用慢病毒敲减舌鳞状细胞癌细胞中的 ZMIZ1 基因,通过体外实验研究其对HUVEC 增殖、迁移和小管形成的影响,体内实验研究其对 CAM 和 TSCC 异种移植瘤血管生成的影响,首次将 ZMIZ1 基因与 PI3K/AKT 信号通路联系起来,研究证明 ZMIZ1 基因可能通过激活 PI3K/AKT 信号通路,促进舌鳞状细胞癌的血管生成。
本文主要的研究结论如下:
(1)通过慢病毒敲减 CAL-27 细胞的 ZMIZ1 基因,体外研究表明敲减ZMIZ1 基因抑制了 HUVEC 细胞的增殖、迁移和小管形成能力,使用 PI3K 通路激动剂 740Y-P 可以逆转敲减 ZMIZ1 基因对 HUVEC 细胞增殖、迁移和小管形成能力的影响,CAM 和裸鼠皮下异种移植瘤模型研究表明 ZMIZ1 敲减可以抑制TSCC 体内的血管生成能力。
(2)通过 qRT-PCR 和 Western blot 检测 PI3K/AKT 通路中 PI3K、p-P85、AKT、p-AKT、VEGF、ZMIZ1 mRNA 和蛋白的表达情况,发现 LV-ZMIZ1 组相关因子的表达量较 Control 和 NC 组低,提示 ZMIZ1 可能通过调控 PI3K、AKT作为致癌基因促进舌鳞状细胞癌的发生发展。敲减 ZMIZ1 基因降低了 TSCC 中PI3K/AKT 相关因子的表达,抑制 VEGF,从而抑制了 TSCC 血管生成。
参考文献(略)
