前 言
氯离子通道在真核、原核生物细胞上广泛分布,它介导的氯离子运输通常被认为是转运阴离子的主要途径。其通道转运蛋白的状态和转运模式对于细胞存活来讲十分重要。研究证实 VSOR Cl-通道在细胞的生理与病理过程中起着重要的作用,如调节细胞增殖、转移、膜电位、pH 值、凋亡等[1-3],且参与了多种心血管疾病,如心肌缺血、心律失常、心肌肥厚、心力衰竭等[4-6]。2014 年,国际权威杂志 Cell、Science几乎同时报道了 LRRC8A 即为 VSOR Cl-通道的编码蛋白[7, 8],并将其重新命名为SWELL 1,这突破了 30 年来本领域对 VSOR Cl-通道成分的未知与茫然。也为本课题的继续深入研究奠定了基础。膜窖是细胞膜上存在的凹陷的结构及功能微区域,其主要的构成成分窖蛋白(caveolin,Cav),也是功能蛋白,它分为三个亚型, Cav-1,Cav-2 和 Cav-3,其中Cav-1 和 Cav-3 对膜窖的功能起着决定性作用,作为结构蛋白也是发生细胞容积改变的重要储备,caveolin 可以接收特异性受体的刺激,通过招募其他分子或分子信号肽、信号转导、多价螯合和内吞、跨膜转运机制,从质膜中有效地去除表面蛋白[9, 10],达到调节细胞的容积变化的作用。
最新研究表明低渗刺激细胞肿胀下 VSOR Cl-通道的开放,不直接是由于机械应力刺激激活,而是涉及到离子强度,及对细胞膜紧张度的敏感性,该通道的激活不仅需要胞内 Ca2+及 ATP 水平,还包括了发挥膜储备作用的 caveolin[11]。目前研究发现许多阳离子通道如 K+、Na+、Ca2+等通道都位于膜窖内[12-15], caveolin 作为一种重要的离子通道结合蛋白可以与这些阳性离子通道及交换体形成复合物,从而发挥调节其通道活性及功能的作用[13, 16-18]。而有关 caveolin 与阴离子通道关系的研究甚少,仅有少数报道证明在缺少 caveolin 的细胞体系中,由细胞体积改变引起的氯电流明显受损,而转染正常的 Cav-1 后,ICl,vol电流又得到恢复,caveolin 可以发挥膜储备的功能以调节 VSOR Cl-通道的开放[19-21]。然而有关 caveolin 与 VSOR Cl-通道的空间关系,是否直接关联调节?如何调控尚未见相关报道。本课题拟在上述研究的基础上,应用全细胞膜片钳、流式细胞仪、氯离子荧光探针、免疫共沉淀等技术等进一步探讨:1.caveolin 与 VSOR Cl-通道的编码蛋白的生化分布及二者的具体定位;2.观察 caveolin 对低渗刺激心肌细胞容积和对低渗刺激胞内 Cl-浓度等功能的影响;3.观察 caveolin 对 LRRC8A 蛋白介导的 ICl,vol电流的影响;4.干扰及过表达 caveolin 后对 LRRC8A 蛋白总量及膜蛋白分布及量的影响。
..........
第一部分:Caveolin-1/3 与 LRRC8A 在心肌细胞膜上的分布及定位
1 材料
①含 10%胎牛血清的 DMEM 培养液:DMEM 培养液购自 Gibico 公司,用时按比例 1:9(胎牛血清:DMEM)配制为含 10%胎牛血清的培养液。②10mM(mmol/L)Brdu:用 10ml 去离子水(doble distilled water,DDH2O)也叫超纯水溶解 30.7mg Brdu 粉剂,使 Brdu 终浓度为 0.1mM。③0.1%胶原酶Ⅱ:用10ml PBS将10mg胶原酶Ⅱ粉剂溶解,使其终浓度成0.1%,用前 0.22 m 滤器过滤以除掉细菌。
..........
2 方法
2.1 小鼠乳鼠心肌细胞的分离与原代培养
①消毒器械、玻璃皿、试管等;②用眼科剪剪取 1-2 天的 C57 小鼠乳鼠的心脏,放入无菌、预冷的 PBS 清洗液,经清洗 3-5 次后,将心脏周边的血块组织及液体清理掉,用眼科小剪刀将心脏剪碎,大小约 1mm。③然后加入含有 0.1%胶原酶Ⅱ的 PBS 缓冲液,充分混匀,加入无菌小转子,在37℃ 恒温磁力仪器上匀速搅拌,反复消化 5~6 次,每次约 4-7 分钟。消化完成后,用干净、无菌的离心管收集细胞悬液,并加入 2 倍体积的含正常含血清的 DMEM 中使其终止消化。上多管架平衡离心机,转速约 1000 r/min,离心 5 分钟。④弃掉上清,用正常含血清培养液重悬沉淀,置于 37℃ 含 5%CO2孵箱,进行差速贴壁,时间约 1 h,目的是获得纯化的心肌细胞。将贴壁好的细胞悬液收集在无菌小玻璃瓶中后,将其置于 200 目钢网上进行过滤,以除去纤维组织等。⑤最后加入 0.1 mmol/LBrdu 用来抑制成纤维细胞的。细胞爬片经高压灭菌后置于培养皿中,最后根据实验需要接种细胞。
2.2 细胞免疫荧光技术
①洗涤细胞:吸去之前的培养液,将待用的细胞用 PBS 缓冲液清洗,摇床上振荡,共 3 次,每次 7 分钟,最后一次尽量将残留液吸干;②固定:适量的细胞固定液加入培养皿,以固定细胞,室温静置 15-30 分钟后,用 PBS 清洗,摇床上振荡,共 3 次,每次 7 分钟;③通透化:0.1%Triton-X-100 的 PBS 通透液覆盖细胞,RT 静置 10-30 分钟。用PBS 清洗,摇床上振荡,共 3 次,每次 7 分钟;④封闭:用适量的驴血清覆盖细胞,室温条件下封闭大概 1h;⑤一抗孵育:用一抗稀释液以合适浓度稀释一抗(1:1000-1:2000),量的多少以覆盖标本为宜,4℃湿盒内孵育过夜;⑥复温:第二天将孵育好的细胞标本置于室温,复温 1h 左右,用 PBST 清洗,摇床上振荡,共 3 次,每次 7 分钟;⑦二抗孵育:用二抗稀释液以合适浓度稀释二抗(1:200-1:1000),量的多少同样以覆盖标本为宜,37℃避光孵育 1h。PBST 缓冲液避光振荡洗涤, 7 分钟×3 次.

........
2 方法 .....67
2.1 H9C2 心肌细胞系的传代培养 ..........68
2.2 H9C2 细胞的瞬时转染 ..........68
2.3 HEK 293 细胞的瞬时转染 ..........68
2.4 细胞总蛋白的提取与定量.....68
2.4 细胞膜蛋白的提取及分离.....69
2.5 pCMV-myc-Cav-1 真核表达载体的构建..........69
2.6 Western-blot 检测目的蛋白及膜蛋白表达水平 .....71
2.7 qRT-PCR 检测 mRNA 水平.....71
2.8 统计学处理.....71
3 结果 ..........71
3.1 siRNA 沉默 Cav-3 RNA 及蛋白水平的检测 .....71
3.2 siRNA 沉默 Cav-1 RNA 及蛋白水平的检测 .....72
3.3 Cav-1 基因沉默后对 LRRC8A 膜蛋白表达水平的影响.....72
3.4 构建 pCMV-myc-Cav-1 的真核表达载体.....73
3.5 Cav-1 过表达对 LRRC8A 膜蛋白表达水平的影响.....74
4 讨论 .....74
4 讨论
膜窖(caveolae)是细胞膜的凹陷样结构,其中存在着大量的膜结合蛋白,许多阳离子通道和涉及信号转导的受体、激酶都集中在caveolae内[101, 112, 113]。膜窖相当于一个作用平台,更有利于上述这些信号分子充分发挥调节作用,最终帮助各个信号通路间实现串联通话(Cross talk)。而caveolin则处于这个信号平台的中心位置。它是一种重要的调节分子,参与了细胞胞吞、血管生成[106, 118]、心血管疾病的保护、肿瘤的发病机制等[116, 143]。 除了其在膜窖中结构的支撑作用,caveolin还可以结合并调节许多信号分子、离子通道的活性和细胞内定位等[14, 115]。本研究已经证实了 caveolin 可能通过抑制 VSOR Cl-通道的开放影响了细胞肿胀情况下细胞体积的增大,也抑制了胞内氯离子的外流。应用基因沉默技术后发现,影响 ICl,vol的激活是 Cav-1 基因而不是 Cav-3。应用基因沉默技术提示 Cav-1 可以影响 LRRC8A 膜蛋白的表达,而 Cav-3 无此作用,但过表达 Cav-1 对 LRRC8A 膜蛋白表达无影响。上述研究说明 Cav-1 可以与 LRRC8A 形成免疫沉淀复合物,且可以调控低渗刺激情况下 LRRC8A 的功能,其中包括对 LRRC8A 膜蛋白表达的影响。离子通道的生物物理特性由它们的三维结构和与调节蛋白的相互作用决定,包括通道亚基的结构和调节蛋白,被称为“通道体”。通道体结构依赖于结合蛋白质组分的微结构域[140]。因此若需明确caveolin与LRRC8A的关系及caveolin调控LRRC8A的具体机制,绝不仅仅是影响了 LRRC8A 膜蛋白表达量的变化。Cav-1 可以在功能上分为三个结构域:N-末端(101aa),跨膜区(33aa)和 C-末端(44aa)。 现已明确定义的 82-101aa 区域被称为 caveolin 支架结构域(CSD),并且已经显示结合广泛的信号分子,包括 G-蛋白亚基,酪氨酸激酶,eNOS,整合素,PKCs,生长因子受体和小 GTP 酶[114]。 研究表明可以与 caveolin 的 CSD 结构域相结合的蛋白部分称之为 CBD 结构域,而在鼠来源的 LRRC8A 氨基酸序列中我们发现了与之相匹配的结构域 AK P 。这为本研究的下一步工作奠定了基础。
...........
小 结
1. 以原代培养的乳鼠心肌细胞为研究对象,应用免疫荧光定位分析及蔗糖密度超速离心检测膜蛋白的分布得出,Cav-1/3 与 VSOR Cl-通道编码蛋白 LRRC8A 存在共定位关系,且在细胞膜上的分布状态一致。
2. Co-IP 实验进一步证实 Cav-1/3 与 LRRC8A 均可能形成免疫沉淀复合物,进一步说明 Cav-1/3 与 LRRC8A 存在体内的生理相互作用。
3. Caveolin-1/3 可以通过抑制 VSOR Cl-通道的开放,而进一步影响低渗刺激细胞容积的增大,及细胞内氯离子浓度的变化。
4. Caveolin 抑制剂 MβCD 可以抑制低渗刺激激活的容积敏感性氯离子电流 ICl,vol,阻断效应同非特异性 Cl-通道阻滞剂 DIDS 类似。
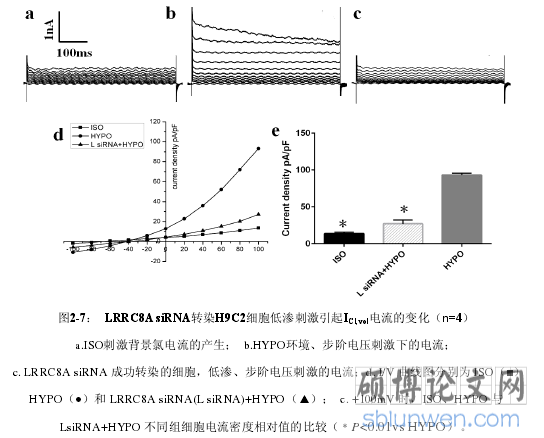
5. 低渗刺激成功转染了 Cav-1 的 siRNA 干扰片段的 H9C2 细胞系,未能检测到正常低渗诱导产生的 ICl,vol,而低渗刺激成功转染了 Cav-3 的 siRNA 干扰片段的 H9C2细胞系,仍能检测到正常的阳性电流 ICl,vol,初步证明了 VSOR Cl-通道的开放需要 Cav-1 的参与而不是 Cav-3。
6. 蛋白免疫印迹法检测 LRRC8A 膜蛋白的表达量随着 Cav-1 蛋白表达的下降而下降,却不随着 Cav-1 蛋白表达的升高而升高,LRRC8A 膜蛋白的表达不受 Cav-3蛋白表达的影响,进一步说明 Cav-1 可能通过调控 LRRC8A 膜蛋白的表达而影响着 VSOR Cl-通道的开放。
..........
参考文献(略)
