前言
肺动脉高压是一种发病率及病死率都相对较高的疾病,患者常因渐进性增长的肺动脉压力而出现右心衰竭甚至死亡。PH 的定义为静息状态下肺动脉平均压(mean pulmonary artery pressure,MPAP)≥25mmHg,平均肺毛细血管楔压(pulmonary capillary wedge pressure,PCWP)、左心房压力或左心室舒张末期压(leftventricular end-diastolic pressure,LVEDP)≤15mmHg[1]。其病理生理机制主要涉及血管收缩、细胞增殖、血管重塑、血栓形成和血管内皮损伤等有关,多种因素的综合作用使肺血管压力进行性升高,右心负荷过重最终导致右心功能衰竭和死亡[2]。肺动脉高压目前没有特效的治疗,预后差,在现有的治疗条件下,患者从诊断肺动脉高压起其平均预期寿命只有 5-7年,死亡率依然很高,已成为全球性的公共健康问题[3]。最近有研究发现 PH 患者血浆中的 ET-1 水平显著增高,且增高的 ET-1 水平与肺血管阻力及 PH 的严重程度相关,确定了 ET-1 在肺血管重塑过程中的重要作用[4, 5]。ET-1 是一种含 21 个氨基酸的多肽,具有丰富的生物学活性,在许多类型的细胞中都有表达,但在肺组织中的 ET-1mRNA 表达水平至少是其他脏器组织的 5 倍,在肺循环中发挥着调节血管收缩、参与血管重塑、促进血管生成等功能[6]。ET-1 被认为与 PH 密不可分,参与其病理生理的发生发展过程,但具体的分子机制及信号转导通路仍不清楚。
由于肺动脉高压的具体发病机制不清,近年来涌现出大量的相关研究,其中有一些研究提示过氧化物酶增殖物激活受体-γ(peroxisome proliferation—activated receptor γ,PPAR-γ)可能通过调节细胞增殖、血管张力和血栓凝结参与了肺动脉高压发病的多种通路的调节,发挥了抗增殖、抗炎、抗氧化的作用。TGF-β1 是 TGF-β超家族中的一种多功能肽,它在多种类型的细胞中均具有调节细胞增殖、分化等作用,与血管的发展、动脉粥样硬化、内膜增生和血管重塑有密切关系[7-9]。有研究表明在 PH 肺动脉血管中可观察到 TGF-β1 的表达增加,并可诱导肺动脉平滑肌细胞生长及胶原沉积[10]。在人肺动脉平滑肌细胞中,TGF-β1 可增强 ET-1 诱导的肺血管重塑[11], Smad2/3 的磷酸化参与了 TGF-β1 诱导的 PH 发生发展[12, 13]。伴有肺部疾病的 PH 其病理生理机制与不伴有肺部疾病的 PH 是不一样的,特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)就是一种常伴有 PH 的疾病[14,15]。肺泡上皮细胞发生上皮间质化(Epithelial to mesenchymal transformation,EMT)已被公认为 IPF 的潜在致病因素,而相关研究表明 TGF-β1 与 A549 细胞的 EMT 有着密切的关系[16, 17]。前人研究提示 TGF-β1 可诱导 549 细胞的 EMT 发生且这一过程中伴有 MAPK通路的激活及 Smad2 的磷酸化[18, 19],而 PPAR-γ激动剂罗格列酮可抑制肺泡上皮细胞中TGF-β1 诱导的纤维化改变[20, 21]。血管内皮素 1(Endothelin-1,ET-1)被认为是与肺动脉高压发病密切相关,而有研究表明 PPAR-γ可影响 ET-1 的水平[22]。目前对 PPAR-γ在肺血管重构中的作用了解甚少。PPAR-γ受体在正常肺组织中有广泛的表达,而重度肺动脉高压患者的肺血管中缺少 PPAR-γ基因及蛋白表达[23, 24]。目前,国内外关于 PPAR-γ、TGF-β1 与 ET-1 之间的相互作用和信号转导机制方面的报道研究很少,三者之间存在怎样的相互关系、是否共同调节肺血管细胞的增殖、维持血管的稳态等问题目前尚不清楚,进一步研究这三者之间的相互作用及信号转导通路有助于阐明 ET-1 表达调控的分子机制。我们推测在 TGF-β1、PPAR-γ、MAPK、Smad 激活和 ET-1 的释放之间存在一定的信号传导关联。TGF-β1 表达增加、PPAR-γ表达减少、PPAR-γ信号转导途径受抑制、与 ET-1 分泌相关的 MAPK、Smad 等细胞信号转导途径激活或异常活跃,增加了 ET-1 的释放和促使肺血管平滑肌细胞增殖。因此,研究 TGF-β1、 ET-1 和 PPAR-γ信号转导、MAPK、Smad 信号通道激活之间的相互关系,特别是 PPAR-γ信号转导和 ET-1 之间的相互作用关系,将能更好的阐明 PH 的发病机理。
.........
第二部分TGF-β1/PPAR-γ介导ET-1表达调控的研究
1 引言
PH 的发病机制十分复杂且至今尚未明确,部分原因是因为许多疾病可以导致 PH 和多个信号转导通路参与了 PH 发生发展的过程。有研究表明许多细胞因子参与了 PH 发生的病理生理机制,其中一些炎性细胞因子的存在、生长因子和转录因子的表达增加有助于直接招募炎症细胞、导致平滑肌细胞和血管内皮细胞增殖而致 PVR 增高[31]。ET-1、TGF-β1、前列环素和一氧化氮与肺动脉平滑肌细胞增殖及 PVR 增高密切相关[6, 56]。有越来越多的证据表明, ET-1 表达的增加和 MAPK 细胞通路的活化与 PH 密切相关[6, 57],MAPK 信号通路及 Smad 信号通路的激活及其与 TGF-β1 的相互作用也被证实与 PH 相关[10, 58-60]。ET-1 是一种含有 21 个氨基酸的小分子多肽,具有强烈的血管收缩作用,1988 年内皮素由日本学者从培养的猪主动脉内皮细胞分离纯化而得[61]。内皮素家族包括 ET-1、 ET-2和 ET-3 三个成员,它们具有高度的同源性及相似的结构,然而其分布和生理作用各不相同[62]。在内皮素家族中,ET-1 对心血管系统的作用尤为突出;大量研究表明,ET-1 参与了 PH、高血压、糖尿病等多种疾病的病理生理过程,PH 患者其血清 ET-1 水平明显增高,且 ET-1 浓度与肺动脉收缩压、心指数及肺血管阻力存在相关性,内皮素受体拮抗剂(如波生坦、安立生坦、马西替坦等)已开始作为新型靶向药物用于治疗 PH 等疾病[5, 63-65]。TGF-β1 是 TGF-β超家族中的一种多功能肽,它具有丰富的生物活性,在多种类型的细胞中均具有调节细胞增殖、分化等作用。相关文献资料显示 PH 中 TGF-β1 的水平是明显增高的,在人肺动脉平滑肌细胞中,TGF-β1 可增强 ET-1 诱导的肺血管重塑,在内皮细胞中,TGF-β1 亦可诱导 ET-1 的表达增加[66, 67],然而这一过程的分子机制尚不明确。
.........
2 结果
A549 细胞为多形性细胞,单层贴壁生长,细胞形态见图 16。TGF-β1(1、2.5、5、10 ng/ml)或 SB203580(1、2.5、5、10 μM)分别作用 24 h 后,记录各组细胞的 OD 值并计算细胞活力。结果显示,不同浓度的 TGF-β1 及 SB203580 对 A549 细胞活力均无明显影响(表 11,12)。选择 TGF-β1 和 SB203580 的干预浓度分别为 10 ng / ml、10 μM,予 SB203580 预处理 A549 细胞 1h 后再予 TGF-β1 作用 12h、24h、36h、48h,记录不同时间的 OD 值并计算细胞活力。结果显示,不同时间的 TGF-β1+SB203580 对 A549 细胞活力均无明显影响(表 13)。
..........
第二部分.............. 27TGF-β1/PPAR-γ介导 ET-1 表达调控的研究........27
1 引言..... 27
2 材料与方法.... 29
2.1 实验细胞株........... 29
2.2 主要试剂和耗材.............. 29
2.3 主要仪器设备....... 31
2.4 细胞培养.... 32
2.5 MTT 法测定 TGF-β1 及 SB203580 作用后对 A549 细胞的活力影响..............33
2.6 细胞的分组与干预.......... 33
2.7 甘油菌复苏及培养.......... 34
2.8 质粒提取.... 34
2.9 质粒瞬转 A549 细胞........35
2.10 激光共聚焦技术............ 39
2.11 ELISA 测定细胞上清液 ET-1 表达....39
2.12 qRT-PCR 检测 A549 细胞 ET-1 及 PPAR-γ的 mRNA 表达...... 41
2.13 Western blot 检测细胞 p38、Smad 蛋白和磷酸化 p38、Smad 的表达.............45
2.14 统计学分析......... 49
2.15 技术路线图......... 49
3 结果..... 50
3.1 TGF-β1 通过 p38 MAPK 及 Smad2 信号通路诱导 ET-1 的表达增加.....50
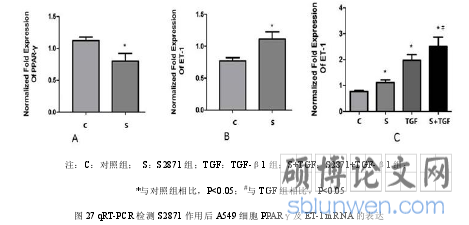
3.2 PPAR-γ通过 p38 MAPK 及 Smad2 信号通路调控 TGF-β1 诱导的 ET-1 表达..........58
4 讨论..... 66
5 结论..... 69
4 讨论
PPAR-γ受体在正常肺组织中有广泛的表达,而重度 PH 患者的肺血管中缺少 PPAR-γ基因及蛋白表达[15]。将缺乏 PPAR-γ表达的内皮细胞注入裸鼠体内后,可引起内皮细胞异常增生,肺血管管腔闭塞。PPAR-γ通过抑制 TGF/Smad 信号途径来抑制细胞因子和生长因子,抑制血管平滑肌细胞增殖迁移, 也可以直接与 Smad3 发生作用,抑制结缔组织生长因子合成[14]。相关文献资料显示 PH 中 TGF-β1 的水平是明显增高的,在人肺动脉平滑肌细胞中,TGF-β1 可增强 ET-1 诱导的肺血管重塑,在内皮细胞中,TGF-β1 亦可诱导ET-1 的表达增加[11, 66];TGF-β1 还可诱导 549 细胞发生上皮-间质转化,加重肺血管重构,而 PPAR-γ激动剂罗格列酮可抑制肺泡上皮细胞中 TGF-β1 诱导的纤维化改变[20, 21]。PH患者血浆中的 ET-1 水平显著增高,且增高的 ET-1 水平与肺血管阻力及 PH 的严重程度相关[4, 5]。上述这些研究结果提示我们 TGF-β1、PPAR-γ和 ET-1 在 PH 病人或是动物模型中都发挥着重要的作用,然而 TGF-β1 和 PPAR-γ如何调节 ET-1 表达的分子机制尚不清楚,本部分的研究目的即是在 A549 细胞中探讨 PPARγ、TGF-β1 和 ET-1 之间的相互作用和潜在的信号转导机制。本研究 MTT 结果提示不同浓度的 TGF-β1 对 A549 细胞活力均无明显影响,ELISA 结果提示,与其他浓度先比 10 ng/ml 的 TGF-β1 刺激 A549 细胞分泌 ET-1 的作用更加明显,因此我们选择对细胞活力影响小而刺激细胞分泌 ET-1 最多的 TGF-β1 浓度作为后续实验的最佳干预浓度即 10 ng/ml。

...........
结论
1. PH患者血清ET-1及TGF-β1蛋白表达水平明显升高,随着PH严重程度的加重,ET-1及TGF-β1蛋白的表达水平越高,且增高的ET-1和TGF-β1之间存在相关性;PH患者肺组织中PPAR-γ的表达明显降低。
2. 在体外培养的 A549 细胞中,TGF-β1 可诱导 ET-1 的表达增加,同时检测到 p38 MAPK及 Smad2 的激活,p38 的特异性抑制剂 SB203580 可抑制 TGF-β1 诱导的 ET-1 表达增加,提示 TGF-β1 通过 p38 MAPK 及 Smad2 信号通路诱导 ET-1 的表达增加。
3. 在体外培养的A549细胞中,PPAR-γ超表达或用S2505刺激,可使TGF-β1诱导的ET-1表达下降,同时检测到p38 MAPK及Smad2的磷酸化降低;PPAR-γ沉默或用S2871刺激,可使TGF-β1诱导的ET-1表达增加,同时检测到p38 MAPK及Smad2的磷酸化增加,提示TGF-β1诱导的ET-1表达受PPAR-γ调控,p38 MAPK及Smad2信号通路在其中发挥重要作用。PPAR-γ和TGF-β1可能通过p38 MAPK及Smad2信号通路调控ET-1表达参与PH的病理生理机制。
..........
参考文献(略)
