第1章 文献综述
1.1 MicroRNA 研究概况
MicroRNA(miRNA)是一类小型非编码的单链 RNA 分子,长度一般为 22 个核苷酸左右(Bartel 2004)。真核细胞的 DNA 和一些病毒的 DNA 都可以编码 miRNA,在动植物真核细胞内的 miRNA 结构高度保守(肖啸 et al 2008)。miRNA 最早是在 1993 年由 Victor Ambrose 和他的同事 Rosalind Lee 等研究秀丽隐杆线虫(C.elegans)的发育时发现的,他们发现基因 lin-4 能够调控秀丽隐杆线虫幼虫的发育,该基因并不编码蛋白质只能编码一对 RNA 分子:一个 RNA 分子是 61个核苷酸,一个 RNA 分子是 22 个核苷酸;其中长的 RNA 分子形成茎环结构是成熟 miRNA(22 个核苷酸 RNA 分子)的前体。lin-4 编码的 RNA 分子与 lin-14 基因的 3’UTR 序列反义互补(Lee et al 1993)。七年后 Reinhart 等又发现了另一微小调节RNA 分子 let-7,let-7 编码一个 22 个核苷酸的 RNA 分子,能够促进秀丽隐杆线虫幼虫的发育(Reinhart et al 2000)。在发现 let-7 一年之后,这类 lin-4 和 let-7 编码的微小RNA 分子不但在秀丽隐杆线虫内被发现,还被报道在果蝇和人的细胞内广泛存在。Lagos-Quintana 和 Lau 等将这类微小 RNA 分子定义为 microRNA( miRNA)(Lagos-Quintana et al 2001; Lau et al 2001; LeeandAmbros 2001)。之后,科研人员陆续在人、果蝇、小鼠、拟南芥和斑马鱼等动植物细胞内发现越来越多的 miRNA,并证实其具有重要的生物学功能(Griffiths-Jones et al2006; Megraw et al2016),对 miRNA的研究也越来越深入。
.........
1.2 MAVS 在抗病毒天然免疫信号通路中的作用研究进展
1.2.1 MAVS 简介
线粒体抗病毒信号蛋白(Mitochondrial antiviral-signaling protein, MAVS),又称为 VISA(Virus-induced signaling adaptor)、Cardif(CARD adaptor inducingIFN-β)或 IPS-1(IFN-β promoter stimulator)是连接视黄酸诱导 I 型基因(Retinoicacid-inducible gene I , RIG-I )受体或黑色素瘤分化相关蛋白 5 ( Melanomadifferentiation-associated protein 5,MDA5)受体与下游免疫信号通路的关键分子。病毒感染机体后激活 RIG-I 或 MDA5 受体,改变构象的 RIG-I 受体或 MDA5 受体通过与 MAVS 相互作用招募相关免疫分子形成复合体,从而激活下游的 IRF3(Interferonregulatory factor 3)或 NF-κB(Nuclear factor-kappa B)通路,诱导机体释放 I 型干扰素和炎症因子,在机体抗病毒免疫中发挥着重要作用(Kumar et al2006)。
1.2.2 MAVS 分子结构与亚细胞定位
MAVS 的分子质量为 56 ku,在不同细胞中分布较为广泛,人源和鼠源 MAVS 基因的同源性为 45%。MAVS 是经典的锚定膜蛋白,在其结构的 N 端富含脯氨酸,是半胱天冬酶的激活和补充区域(Caspase activationand recruitment domain, CARD),MAVS 通过其 CARD 与 RIG-I 和 MDA5 受体互作;MAVS 的 C 端是跨膜区域,MAVS可以通过其 C 端的 TM 结构域锚定到多种膜的表面,包括过氧化物酶体、线粒体,或者亚定位在内质网的表面,即线粒体相关膜(Mitochondrion-associated membrane,MAM)。在 MAVS 的结构中同样含有肿瘤坏子因子受体相关因子(Tumor necrosisfactor receptor-associated factor, TRAF)互作基序,两个是在富含脯氨酸区域,一个在跨膜区域(Dixit et al 2010; Horner et al 2011; Seth et al 2005)。(如图 1-2-1)多种因素影响 MAVS 不同的亚细胞定位,其具体机制现在还不清楚。根据现有研究进展,MAVS 锚定在膜上是其发挥抗病毒作用的前提,在 MAVS 跨膜区域中特定的蛋白与宿主相应蛋白的相互作用影响其不同的亚细胞定位,使其能够锚定在多种膜表面,与宿主细胞膜的广泛互作在其发挥抗病毒功能中起着关键作用(Edwards et al 2013; Seth et al 2005)。
........
第 2 章 研究目的及意义
miRNA 是一类单链非编码的 RNA 分子,长度一般为 22 个核苷酸左右,通过碱基序列互补结合靶基因来降解靶基因 mRNA 或抑制其转录后翻译。近年来研究表明miRNA 不仅广泛参与细胞增殖、脂肪代谢、神经发育等生理进程,还在天然免疫及病毒的感染中发挥重要的调控作用。病毒感染会引起宿主细胞 miRNA 的表达发生变化,差异表达的 miRNA 进而又能调控病毒的感染影响病毒的复制及调控病毒引起的炎症反应。在人神经胶质瘤细胞上那些 miRNA 参与调控 I 型干扰素和炎症因子的表达还有待研究。为了探究参与病毒刺激神经胶质细胞过程中的 miRNA,进一步阐明 miRNA 在RNA 病毒模拟物 poly(I:C)诱导的 I 型干扰素和炎症反应中的生物学功能。本研究以poly(I:C)诱导差异表达的 miR-22 为切入点,鉴定了 miR-22 的一个新靶标 MAVS,解析了 miR-22 调控 I 型干扰素和炎症因子表达的分子机制,为研究 miRNA 在中枢神经系统感染免疫反应中的功能提供参考依据。
.......
第 3 章 材料与方法.......22
3.1 实验材料 ..... 22
3.2 实验方法 .........29
第 4 章 结果与分析........41
4.1 Poly(I:C)显著诱导 miR-22 的上调表达 .....41
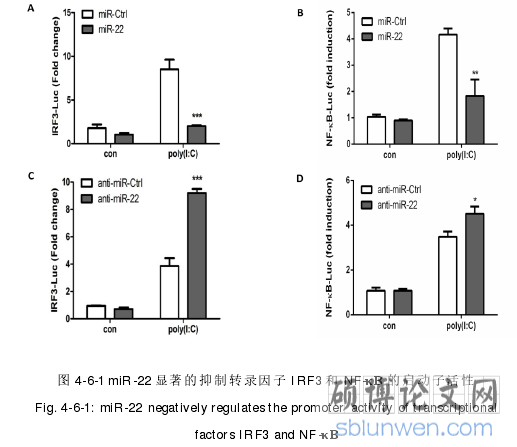
4.2 miR-22 负调控 poly(I:C)诱导的 I 型干扰素和炎性细胞因子的表达 ......42
4.3 miR-22 靶向 MAVS .....46
4.4 Poly(I:C)处理细胞抑制 MAVS 的表达 ......48
4.5 miR-22 通过靶向 MAVS 负调控 poly(I:C)诱导的 I 型干扰素和炎症因子的表达.........50
4.6 miR-22 抑制 MAVS 下游的干扰素通路 ............53
4.7 JEV 感染细胞上调 miR-22 的表达同时抑制 MAVS 的表达 ...........58
第 5 章 讨论.....60
5.1 Poly(I:C)诱导 miR-22 的上调表达 ........ 60
5.2 miR-22 负调控 poly(I:C)诱导的 I 型干扰素和炎症因子的表达 ......... 61
5.3 miR-22 促进 JEV 在 U251 细胞上复制......... 63
第 5 章 讨论
天然免疫是中枢神经系统免疫防御系统的重要组成部分,中枢神经系统的天然免疫防御主要依靠胶质细胞来完成(Farina et al2007)。病毒感染中枢神经系统后,会激活小胶质细胞和星形胶质细胞,激活的小胶质细胞和星形胶质细胞会通过释放 I型干扰素、炎症细胞因子以及趋化因子发挥免疫防御作用(Detje et al2015; Ghoshaletal 2007)。miRNA 是调节基因表达的关键分子,通过碱基序列互补结合靶基因来降解靶基因 mRNA 或抑制其转录后翻译。越来越多的研究表明 miRNA 广泛参与细胞增殖分化、细胞凋亡、器官形成等生理进程,同时还在天然免疫及病毒感染过程中发挥重要的调控作用。病毒感染及天然免疫通路的激活会引起 miRNA 的表达发生变化,差异表达的 miRNA 进而又能调控天然免疫反应和病毒的感染。在本研究中我们发现 miR-22 在 poly(I:C)和 JEV 感染细胞过程中上调表达,负调控 poly(I:C)诱导的 I 型干扰素和炎症因子的表达。
5.1 Poly(I:C)诱导 miR-22 的上调表达
病毒感染细胞后会激活一系列的信号通路,诱导宿主细胞 miRNA 的表达发生变化,这些差异表达的 miRNA 通过靶向病毒基因组本身或者靶向其它的免疫分子调控病毒的复制和宿主的抗病毒免疫反应(Chenet al2017; Machitani et al 2017)。例如,PRRSV 感染能够诱导 miR-24-3p 的上调表达,上调表达的 miR-24-3p 通过抑制 HO-1的表达促进 PRRSV 的复制(Xiao et al2015);EV71 感染人 RD 细胞和 SK-N-SH 细胞能够显著的上调 miR-296-5p 的表达,上调表达的 miR-296-5p 通过直接靶向 EV71病毒基因组的 VP1 和 VP3 基因显著的抑制 EV71 的复制(Zheng et al 2013)。在本研究中,我们发现病毒 RNA 模拟物 poly(I:C)处理 U251 细胞能够上调 miR-22 的表达,且呈时间和剂量的依赖性(图 4-1-1A、B);另外,我们为了验证 poly(I:C)诱导 miR-22的上调表达是否具有细胞特异性,我们验证了poly(I:C)处理SH-SY5Y细胞后 miR-22的表达情况,结果显示 poly(I:C)处理细胞后,miR-22 在 SH-SY5Y 细胞上的表达情况与在 U251 细胞上是一致的(图 4-1-2)。在 miRNA 的生物合成过程中,其最初是在核内 RNA 聚合酶的作用下转录成为5’端有 cap 的具有颈环结构的初级 pri-microRNA,初级 pri-microRNA 在 DGCR-8 作用下被 Drosha 酶的 RNaseIII 区域切割形成 70 个核苷酸左右具有发卡结构的前体(pre-microRNA)(FallerandGuo 2008; Gregory et al 2006)。细胞核内核转运蛋白Exportin-5 识别 pre-microRNA 后将 pre-microRNA 转运到细胞质中(Yi et al 2003)。在细胞质中 pre-microRNA 被 RNase III Dicer 酶切割为 22 个核苷酸的双链 RNA 分子(Chendrimada et al 2005)。在本研究中我们不仅验证了 poly(I:C)诱导 miR-22 的上调表达,还证实了 poly(I:C)能够诱导 miR-22 的初始转录物(pri-miR-22)及前体(pre-miR-22)的上调表达(图 4-1-1 C、D),且都呈时间依赖性,证明了 poly(I:C)在转录水平诱导 miR-22 的上调表达。从结果来看,poly(I:C)够诱导的 pri-miR-22 及pre-miR-22 的上调倍数与 poly(I:C)够诱导的成熟 miR-22 的上调倍数不一致,这可能与 miR-22 在转录后水平以及转移至细胞质过程中受到其它因素的调节有关,具体调节机制有待于进一步研究。

.........
结论
1. Poly(I:C)处理细胞上调 miR-22 的表达,并且 poly(I:C)处理细胞能够上调 miR-22的初级转录物 pri-miR-22 和前体 pre-miR-22 的表达。2. miR-22 参与 poly(I:C)诱导的炎症反应,过表达 miR-22 抑制 poly(I:C)诱导的 I 型干扰素和炎症因子的表达,抑制内源性的 miR-22 会促进 poly(I:C)诱导的 I 型干扰素和炎症因子的表达。3. MAVS 是 miR-22 的靶基因,miR-22 通过靶向 MAVS 调控 I 型干扰素和炎性细胞因子的表达。4. JEV 感染神经胶质细胞诱导 miR-22 的上调表达,细胞过表达 miR-22 可以促进 JEV的复制。
..........
参考文献(略)
