第 1 章 前言
1.1 狂犬病及狂犬病毒概述
狂犬病是由狂犬病病毒(Rabies Virus, RABV)引起的人兽共患传染病。狂犬病的宿主除了犬和猫外,还有狼,浣熊,臭鼬和蝙蝠等。人的狂犬病有 99%都是从家养的犬传播而来,狂犬病毒感染家养或野生动物后,通过咬伤、抓伤或者唾液传染给人类。在中国有 95%以上的狂犬病例是由发病的犬传染给人类[1, 2],而在北美,狂犬病只是区域性的发生,主要是由感染了狂犬的蝙蝠传染给人类[3]。该病在全球分布广泛,且一旦发病,死亡率几乎为 100%,因此给人类健康带来巨大的威胁。全球每年有 4 万到 7 万人因狂犬病死亡[4](图 1-1)。最近有研究表明,狂犬病每年在全球的致死人数有可能是官方发布人数的 100 倍以上,并且有 40%的感染者是儿童[5]。新中国成立以来,我国经历了至少三次狂犬病大流行。第一次是在上世纪 50 年代;第二次大流行是从 70 年代末到 90 年代初,1981 年死于狂犬病的人数达 7 千多人;到 90 年代中期死于狂犬病的人数逐渐减少至一百多人。由于没有开展广泛的动物免疫工作,死于狂犬病的人数又逐年上升,形成第三次流行。2002~2007 年,全国狂犬病死亡 11198 例,占同期各种传染病病死数的 30%,高居所有法定传染病病死数之首[6-8]。麻痹型在亚洲由犬、猫等肉食动物传播,在南美洲可因被吸血蝙蝠咬伤或吸入含病毒的气溶胶而感染。此型病人的病理损伤主要在脊髓和延髓,与狂躁型相反,麻痹型狂犬病患者的中枢神经系统处于抑制状态。临床上主要是先出现发热、头痛、呕吐和咬伤部位疼痛等症状,然后开始出现共济失调、四肢软瘫,以及不同程度的感觉障碍等症状。在病程的早期用叩诊锤叩击胸肌,可见被叩胸肌隆起,数秒后平复。
........
1.2 狂犬病毒病原特征
狂犬病病毒(Rabies virus,RABV)是一种非常典型的具有嗜神经特性的病毒,狂犬病毒属于弹状病毒科(Rhabdoviridae)狂犬病毒属(Lyssavirus)。弹状病毒科共有 175 种以上成员。本科分三个属,水泡性口炎病毒属、西格玛病毒属和狂犬病毒属,其中狂犬病毒是最重要的致病病毒。这些病毒基因组均为单链、不分节段的负链 RNA。狂犬病毒的核蛋白序列保守,按照血清学反应和单克隆抗体抗原交叉反应,一般将狂犬病毒属分成 4 个血清型[11]。血清 1 型指狂犬病病毒(Rabies virus, RABV),包括目前经典的狂犬病毒,是流行最广泛的血清型;血清 2 型是指 Lagos 蝙蝠病毒;血清 3 型是指 Mokola 病毒;血清 4 型是指 Duvenhage 病毒[12, 13]。针对狂犬病相关病毒多样性的遗传进化研究,根据狂犬病毒核蛋白、糖蛋白和磷蛋白的特征,狂犬病毒属一般可以分成 7 种基因型。其中基因 1- 4 型分别对应血清 1- 4 型;欧洲蝙蝠狂犬病病毒 1 对应的是基因 5 型;欧洲蝙蝠狂犬病病毒 2 对应的是基因 6 型;而 1997 年从澳大利亚果蝠中分离到的狂犬病病毒对应的是基因 7 型[14]。我国流行的狂犬病毒一般是狂犬病病毒基因 1 型。基因 2- 6 型目前仅在非洲和欧洲发现,极少感染人,但几乎每种基因型都有致死的病例发生。
..........
1.3 病毒的感染和复制过程
狂犬病毒在体内的过程可以分为三个阶段,第一个阶段主要是狂犬病毒与宿主受体结合、内吞,然后释放病毒基因组到细胞质中,接着病毒粒子就被逆着轴突方向转运至神经元[51],病毒到达神经元胞体后即开始了感染的第二个阶段。第二个阶段主要合成病毒粒子的一些必须组分,包括基因组转录、复制以及蛋白的合成。最后一个阶段即为病毒的组装和释放,组装好后释放的病毒粒子有感染能力,又开始了新一轮的感染。病毒的感染过程从宿主被唾液中有狂犬病毒的发病动物咬伤开始,病毒从伤口入侵。狂犬病毒通常不会侵入血液,也不会引起病毒血症。病毒从入侵部位的神经组织开始向心传播,直至进入中枢神经系统[51]。病毒传播、扩散过程的时间长短和潜伏期相关,潜伏期又与病毒入侵部位以及入侵数量相关。病毒移动的速度通常为每天 15- 100 mm。在病毒进入中枢神经系统前接种疫苗,使机体产生抗体,可以预防发病。病毒进入中枢神经系统以后,即开始大量增殖,同时会引起神经细胞功能紊乱,感染者开始显露出临床症状,一旦临床症状开始出现通常无法医治。在中枢神经系统中,病毒大量复制后,又可以通过传出神经继续向外传播,并扩散到周围神经以及这些周围神经所支配的组织中。并且在这个阶段,病毒可以通过唾液腺排除体外。出现典型症状后,感染者可在一周内死亡。
.........
第 2 章 研究目的及意义
由狂犬病毒(Rabies virus, RABV)引起的狂犬病是一种严重的致死性疾病,尤其在发展中国家多发。我国每年因狂犬死亡的人数仅次于印度,成为狂犬病严重流行的国家之一,对公共安全造成极大的威胁。狂犬病毒感染后转录产生五个结构蛋白的 mRNA(N、P、M、G 和 L)和一个不编码任何基因的先导 RNA。在之前的研究中发现先导 RNA 的 5’端没有帽子结构,3’端没有 polyA 尾巴,是一段两端裸露的 RNA。用固定毒感染 BHK-21 细胞发现先导RNA长度主要是56 nt和58 nt,但是也有其他的长度,并且先导RNA可以与RABV的 N 蛋白互作,与宿主的 LA 蛋白互作,同时先导 RNA 可以激活树突细胞。但是先导 RNA 在病毒感染中发挥的具体作用尚不清楚。本研究从先导 RNA 的产生开始,使用 RACE 方法建先导 RNA 文库,并结合Sanger 测序和高通量测序,系统的研究了先导 RNA 的转录起始和终止位点。并且我们在细胞和小鼠体内分别过表达了先导 RNA,阐明了先导 RNA 的作用。然后利用tRSA 蛋白和 RNA 互作研究方法,找到了先导 RNA 在宿主中的互作蛋白,以及蛋白对先导 RNA 和病毒复制的影响。最后我们用 AAV 载体在感染了 RABV 的小鼠体内表达先导 RNA,研究了先导 RNA 用于狂犬病毒暴露后预防的可行性。本研究解释了狂犬病毒先导 RNA 在病毒感染中发挥的作用,以及和宿主的互作关系,并且为狂犬病毒暴露后预防提供了新的思路。
..........
第 3 章 材料与方法.......21
3.1 材料 ...........21
3.2 方法 ...........26
第 4 章 结果与分析.......40
4.1 狂犬病毒安徽株 DRV-AH08 先导 RNA 的结构 .....40
4.2 在体外和体内过表达先导 RNA 均能抑制 RABV 的感染 ........... 45
4.3 先导 RNA 通过抑制 RABV 的 N 蛋白与基因组结合来抑制 RABV 的复制 ... 54
4.4 先导 RNA 能与宿主蛋白 Hsc70 互作 ........... 57
4.5 抑制 Hsc70 的表达能上调先导 RNA 的水平并抑制 RABV 复制 .......... 61
4.6 Hsc70 可以通过调节先导 RNA 的水平来影响 RABV 的复制 ..... 66
4.7 先导 RNA 在 RABV 暴露后预防中有潜在的作用 ............ 69
第 5 章 讨论.......73
5.1 RABV 先导 RNA 的长度 .......... 73
5.2 RABV 先导 RNA 的功能 .......... 74
5.3 RABV 先导 RNA 的互作蛋白 ............. 76
5.4 RABV 先导 RNA 可用于 RABV 暴露后预防 .......... 77
第 5 章 讨论
5.1 RABV 先导 RNA 的长度
病毒与宿主之间的互作形式复杂多样,从核酸水平到蛋白水平都有不同程度的相互影响,由于几乎在所有物种中 ncRNA 都发挥巨大的功能,因此病毒和宿主互相影响的过程中通常也会产生不同的 ncRNA。真核生物的 ncRNA 已经被广泛的研究过,但是病毒在感染过程中产生的 ncRNA 研究的还较少。很早就有关于单股负链RNA 病毒(如 VSV 和 RABV)产生的 ncRNA 的报道,这段 ncRNA 被称为先导 RNA,从病毒基因组的 3’末端转录而来[19, 151]。之前的研究表明,不同血清型的 VSV 可以转录产生长度从 50 nt 到 53 nt 不等的先导RNA[151]。Kurilla MG 等报道了RABV的先导RNA,他们使用一株固定毒RABV感染 BHK-21 细胞,感染后 12 小时用 SDS-PAGE RNA 印记法检测了先导 RNA,结果表明先导 RNA 主要转录终止位点位于基因组 55 nt 到 58 nt 之间,但是也有一些终止在 43 nt 和 60 nt 的位置[19]。在本论文中,我们使用了更为精确的 RACE 技术来研究先导 RNA 的长度。我们使用感染 DRV-AH08 的鼠脑来研究先导 RNA 的长度,发现先导 RNA 转录终止位点从 40 nt 到 79 nt 不等,但是主要的终止位置在 64 nt。为了进一步确定先导 RNA 的长度,我们又用 DRV-AH08 感染 SK-N-SH 细胞,并在感染早期即收集细胞,同时也用了另外一种方法建先导 RNA 文库,并做了高通量测序进行分析。高通量测序的结果与之前 Sanger 测序结果一致,先导 RNA 的转录终止位点大部分在 64 nt 的位置。并且测序结果中仍然有一些比 64 nt 长的 RNA,这有可能是通读的转录产物,但是这种较长的 RNA 产生的机制仍然不明确。在本论文中,通过建先导 RNA 文库再测序的方式得到先导 RNA 的转录终止位点,与之前报道的先导 RNA 长度不完全一致,这有可能是因为我们使用了不同的研究方法,也有可能是因为我们使用了不同的毒株,之前的文献使用的是 RABV 固定毒感染 BHK-21 细胞,本论文中使用的是 RABV 街毒株感染小鼠和 SK-N-SH 细胞。这种先导 RNA 长度不一致的具体机制仍需要进一步研究。
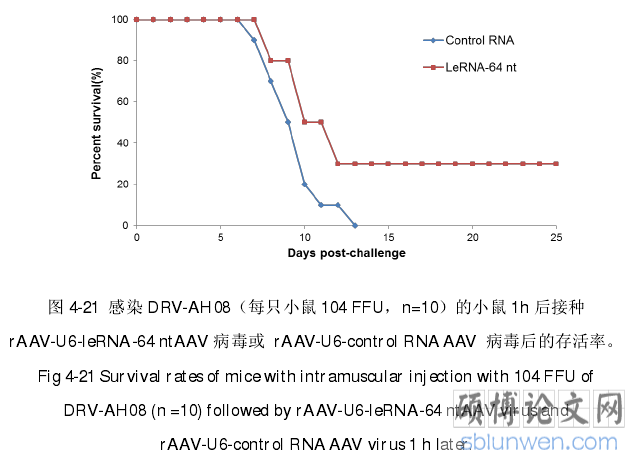

..........
结 论
1. 以狂犬病毒街毒株 DRV-AH08 为模型,来研究狂犬病毒先导 RNA 的合成和结构。使用 RACE 方法建先导 RNA 文库,并结合 Sanger 测序和高通量测序,我们发现先导 RNA 的长度并不固定,且 3’末端有一定的编辑,但是大部分先导 RNA 的转录终止位点位于基因组 64 nt 的位置,转录起始位点全部在基因组第 1 个碱基。分析不同长度先导 RNA 的二级结构,发现它们二级结构相似。
2. 体外试验通过转染过表达先导 RNA 的质粒和直接转染体外转录产生的先导RNA,我们发现先导 RNA 在细胞中对 DRV-AH08 感染有抑制作用。同时在体内试验中,通过脑三维立体定位注射,在小鼠脑内过表达先导 RNA 发现,在活体中先导 RNA 仍可以抑制 DRV-AH08 的感染。利用 RNA 免疫共沉淀试验我们发现,先导 RNA 抑制狂犬病毒的复制可能是通过抑制狂犬病毒 N 蛋白与基因组RNA 的结合。
3. 用 RNA-蛋白互作系统找到了宿主中先导 RNA 互作蛋白 Hsc70,并验证了 Hsc70与先导 RNA 的互作。同时抑制 Hsc70 的表达时,先导 RNA 水平上升,并且狂犬病毒毒价下降,说明 Hsc70 可以对先导 RNA 有负调控作用,而对狂犬病毒复制有正调控作用。而狂犬病毒感染早期(2 小时),Hsc70 的表达水平显著性下降,但是在感染后 36 小时,Hsc70 的表达水平又显著高于对照组,结合之前的结果说明,狂犬病毒、Hsc70 和先导 RNA 之间存在互相影响的机制。
4. 在感染了 DRV-AH08 的细胞中,过表达先导 RNA 时,先导 RNA 仍然可以抑制病毒的复制,但在感染了 VSV 的细胞中过表达 DRV-AH08 的先导 RNA,并不能产生对 VSV 的抑制作用,说明先导 RNA 能在狂犬病毒感染后发挥抑制作用,并且这种抑制作用是特异性的。在感染了 DRV-AH08 的小鼠体内的同一位置注射过表达先导 RNA 的 AAV 病毒,可以显著提高小鼠的存活率,说明先导 RNA 或许可用于狂犬病毒的暴露后预防。
..........
参考文献(略)
