第 1 章 引 言
嗜睡不仅使个人在多个领域的社会功能发展严重下降,给工作及生活带来很大影响,甚至酿成意外事故而危及自身及他人安全。嗜睡可能是由医疗条件、睡眠障碍、非法和处方药物、工作和家庭的需要(包括轮班工作)以及睡眠时间不足引起的[1]。患者的嗜睡症状与中枢神经系统功能障碍有关,称为中枢性睡眠增多,其主要的主诉是白天过度嗜睡(EDS),EDS不是由于夜间睡眠中断或昼夜节律紊乱引起的。发作性睡病是一种可致残的睡眠障碍,分为发作性睡病1型和发作性睡病2型;发作性1型的特征在于白天嗜睡和猝倒发作,经常伴有睡眠幻觉和睡眠瘫痪,主要是由于特异性缺失的下丘脑泌素(Hcrt),也被称为食欲素神经元的缺失[2, 3]。潜在的发病机制尚不明确。目前现有的数据支持Hcrt能神经元的自身免疫性破坏作为最可能的假设[2,3]。发作性睡病的诊断需要夜间PSG及MSLT记录显示平均睡眠潜伏期小于8分钟,有两个或以上的SOREMP或Hct-1在脑脊液中降低[4]。发作性睡病2型和特发性睡眠增多(IH)发病机制尚不明确,两者主要的基本特征为日间过度嗜睡而无猝倒发作。NT2的诊断需要PSG-MLST监测,MLST显示平均睡眠潜伏期低于8分钟和两个或以上SOREMP,以及CSF中正常水平的hcrt-1[4]。特发性睡眠增多的MSLT通常显示平均睡眠潜伏期低于8分钟和少于两个SOREMP[4]。Kleine-Levin综合征(KLS)属于周期性睡眠增多,临床特征是反复发作的重度嗜睡,伴有认知、行为和精神障碍例如贪食(典型的强迫性饮食),性欲亢进,易激惹和情绪障碍(情感淡漠,失实症)[5]。睡眠是每次发作中存在的主要症状。持续几天或几周的发作是由正常行为、情绪和睡眠阶段分开的。KLS的病理生理机制是尚不清楚,诊断主要是基于症状,没有客观的定义和诊断标准。
脑血流自动调节(cerebral autoregulation,CA)是大脑的一种自身保护机制,是指脑血流在动脉血压和脑灌注压发生变化时保持相对稳定的能力。当脑血流自动调节功能受损时,脑血流量会随着脑灌注压的升高或降低而变化,从而导致脑组织过度灌注或灌注不足。脑血流自动调节分为静态调节(static cerebral autoregulation, sCA)和动态调节(dynamic cerebral autoregulation, dCA)[6]。目前,对于脑血流自动调节功能的评估和量化国内外尚无界定“金标准”。近年来,随着经颅多普勒超声(transcranial doppler,TCD)和连续无创血压测量技术的发展,实时同步监测脑血流速度(cerebralblood flow velocity,CBFV)和动脉血压(ABP),即动脉血压和脑血流量的瞬时变化,使用传递函数分析(transfer function analysis,TFA)来评价动态脑血流自动调节功能。有研究发现,脑血流自动调节功能受损参与多种疾病的发生和发展,尤其是与脑血管疾病(动脉狭窄、缺血性卒中、蛛网膜下腔出血、脑出血)密切相关。Nasr 等研究表明,阻塞性睡眠呼吸暂停患者在觉醒期间脑血流自动调节受损且脑血流自动调节障碍与阻塞性睡眠呼吸暂停的严重程度相关[7]。目前尚无对中枢性睡眠增多患者动态脑血流自动调节的研究,我们假设中枢性睡眠增多患者动态脑血流自动调节功能受损,本研究旨在明确中枢性睡眠增多患者动态脑血流自动调节功能变化,并探讨其可能的病理生理机制,为指导临床治疗提供更多依据。
......
第 2 章 综 述
2.1 睡眠与觉醒神经调节机制
每天的觉醒和睡眠周期由觉醒和睡眠调节神经电路之间相互协调作用而调节的。觉醒与脑干和基底前脑胆碱能神经元,脑干和下丘脑后部中的单胺能神经元以及外侧下丘脑中的下丘脑分泌素(hypocretin)神经元的神经元活动相关,一方面以协调方式来刺激皮层激活,另一方便是行为唤醒[8]。这些神经元群有助于大脑觉醒相关功能的不同方面。从觉醒到睡眠的正常过渡包括睡眠相关的抑制和(或)多种觉醒系统的抑制。研究表明,清醒状态主要受胆碱能和单胺能神经通路调节[9]。胆碱能觉醒通路从桥脑被盖网状核(PPT)和脑干被盖背外侧核(LDT)到丘脑中继核。这些神经元也参与快眼动(REM)睡眠的产生。单胺能神经通路起源于他们各自的核团——去甲肾上腺素能蓝斑核、 血清素中缝核、 组胺结节乳头体核、 多巴胺能的中脑导水管周围灰质及谷氨酸臂旁核——并投射到下丘脑外侧和皮层。在睡眠开始时关闭唤醒系统网络的细胞组高密度出现在腹侧外侧前区(VLPO)和下丘脑内侧视前核(MnPN)中[8]。视前神经元在睡眠期间被激活并且表现出睡眠 - 觉醒状态依赖性放电模式,其是相互的在几个觉醒系统中观察到。在VLPO中的神经元含有抑制性神经调节剂甘丙肽和抑制性神经递质γ-氨基丁酸(GABA)。大多数MnPN睡眠活跃的神经元合成γ-氨基丁酸。VLPO和MnPN神经元是投射到后部及外侧下丘脑和喙侧脑干中的觉醒调节系统的来源。
..........
2.2 导致日间过度嗜睡的疾病
引起日间过度思睡的原因众多,与环境因素和生活习惯相关者占第一位。睡眠呼吸障碍为日间过度思睡最常见的病因,发作性睡病居其次,其余包括周期性腿动、周期性嗜睡、特发性睡眠增多、睡眠不足等。睡眠呼吸障碍是一组以呼吸节律异常和通气异常为主要特征的疾病,可伴或不伴清醒期呼吸异常。包括阻塞性睡眠呼吸暂停综合征、中枢性睡眠呼吸暂停综合征、睡眠相关的低通气综合征、睡眠相关的低氧血症、夜间呻吟等,其中以阻塞性睡眠呼吸暂停低通气综合征(OSAHS)最为常见、危害最大。在阻塞性睡眠呼吸暂停中病理事件是由于上呼吸气道的关闭致睡眠中呼吸暂停,或通气暂停和低通气(呼吸浅)。OSAHS病因复杂,其发病率估计在女性为 9%,男性为 17%[10]。阻塞性睡眠呼吸暂停的特征在于反复发作的整体(呼吸暂停)或部分(呼吸不足)上气道塌陷,其持续≥10 秒并且在睡眠期间发生,导致呼吸暂停和呼吸不足,重复的血氧脱饱和,以及睡眠唤醒。夜间这些事件的重复发生可导致突出的睡眠断裂和与阻塞性睡眠呼吸暂停相关的典型体征和症状的发展。这些症状可以分为在白天(例如,白天嗜睡,早晨头痛,不能集中等)和夜间发生的那些(例如,睡眠期间打鼾,窒息或喘息,不安眠,夜尿)中发生的那些症状。此外,阻塞性睡眠呼吸暂停与心血管并发症相关,如动脉高血压、肺动脉高压、心律失常,中风,以及糖尿病和代谢综合征[11]。白天嗜睡会对注意力、日常生活质量、工作绩效和安全性产生负面影响,甚至危及生命。对于睡眠呼吸暂停患者日间嗜睡的原因尚不清楚,有文献报道呼吸暂停或呼吸不足的严重程度可能与由苏醒产生的睡眠断裂的严重程度密切相关[12]。有一个意见认为睡眠呼吸和睡眠中断可能不是所有阻塞性睡眠呼吸暂停患者中 EDS 的主要决定因素,因为在有 EDS 和无 EDS 的患者中 AHI 的差异是轻微的尽管有统计学意义[13]。在对血浆神经肽和激素代谢水平的研究,增加循环下丘脑分泌素-1 和降低循环生长释放肽水平,这是参与能量平衡、交感神经张力和睡眠觉醒周期的调节肽,与阻塞性睡眠呼吸暂停患者 EDS 相关[14]。炎症标记物也被研究作为睡眠的生物标志物[15]。C 反应蛋白的增加与短期睡眠剥夺有关[16]。另外,细胞因子、肥胖、代谢异常(如糖尿病、胰岛素抵抗)及高碳酸血症等与嗜睡有关。
....
第 3 章 材料与方法....11
3.1 研究对象 .....11
3.1.1 入组标准 ......11
3.1.2 排除标准 .......11
3.2 主要检查设备及方法..... 12
3.3 数据分析 .... 14
3.4 统计方法 .... 14
第 4 章 结 果....... 15
4.1 研究对象的一般情况..... 15
4.2 Epworth 睡眠评分(ESS) ......... 15
4.3 动态脑血流自动调节的参数....... 16
4.3.1 相位差 PD ........ 16
4.3.2 增益(Gain) ......... 17
4.4 发作性睡病治疗前后 ESS、动态脑血流自动调节的参数........ 18
第 5 章 讨 论....... 20
5.1 嗜睡组与脑血流自动调节.... 20
5.2 发作性睡病不伴 RBD 与脑血流调节....... 21
5.3 发作性睡病伴 RBD 与脑血流调节.... 22
5.4 发作性睡病治疗前后与脑血流自动调节的变化.......... 23
5.5 本研究的不足之处......... 24
第 5 章 讨 论
日间嗜睡是指在白天主要清醒时段不能保持清醒和警觉,导致难以抑制的需要睡眠或无意识的陷入困倦或睡眠。嗜睡可有不同的严重程度,更容易发生在几乎不需要主动参与的情况下,如久坐、无聊、单调的环境。在大多数情况下,过度嗜睡是一种慢性症状,持续时间大于 3 个月才能考虑诊断[4]。日间嗜睡严重程度可以用主观的量表如 Epworth 睡眠评分和客观的多次睡眠潜伏期试验(MSLT)量化。中枢性睡眠增多疾病的特点在于白天过度嗜睡, MLST 平均睡眠潜伏期<8 分钟是用来定义嗜睡用于诊断。多巴胺、去甲肾上腺素和 5-羟色胺属于一组涉及上升网状激活系统的神经递质[59]。这些神经递质分布在脑干网状结构、丘脑、后下丘脑和基底前脑。谷氨酸是通过丘脑-皮层投射系统刺激皮层激活的主要神经递质。在脑桥-中脑被盖和基底前脑中的乙酰胆碱在醒来和快动眼(REM)睡眠期间促进皮层激活。组胺和下丘脑泌素分别参与执行和维持清醒。蓝斑核去甲肾上腺素和背缝核的 5-羟色胺促进清醒状态和预防快眼动(REM)睡眠。腹侧中脑的多巴胺在觉醒和快眼动(REM)睡眠期间刺激高度积极的状态。脑血流自动调节是大脑的一种自我保护机制,当平均动脉压在 60-160mmHg 之间时,脑血管平滑肌可以随着血压的变化相应的收缩或舒张,脑血流量(CBF)保持相对恒定。肌源机制抑制血压突然改变;交感神经元,去甲肾上腺素能纤维的神经源性影响主要调节脑动脉的近端,大直径段,也可调节 15 - 20μ 米直径的血管;副交感神经,血管舒张冲动影响较小;单胺类神经脑干中枢如中缝背核、蓝斑核、脑桥嘴网状核也影响血管张力;代谢,局部实质和血管内皮物质对脑血管张力产生重大影响,尤其重要的是一氧化氮、降钙素基因相关肽、P 物质、内皮素、钾通道和自体有效物质如组胺、缓激肽、前列腺素、白三烯、花生酸、自由基或 5-羟色胺[60]。我们假设中枢性嗜睡患者动态脑血流自动调节功能受损,进一步研究中枢性睡眠增多患者动态脑血流自动调节变化,探讨其可能的病理生理机制。
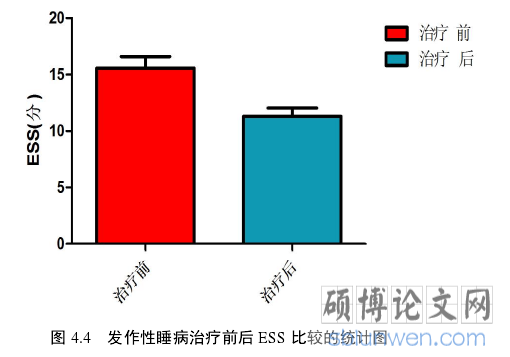

.........
结论
发作性睡病当前使用的药物是针对症状的,通常用用于白天过度嗜睡的兴奋剂和用于猝倒的抗抑郁药的组合治疗。单胺类神经递质,特别是多巴胺,促进觉醒,而一些如去甲肾上腺素和 5-羟色胺抑制猝倒。本研究中对于 7 名发作性睡病伴猝倒患者进行治疗前后观察,结果显示日间过度嗜睡症状较前缓解,治疗后相应半球的相位差比治疗前的明显升高,增益无显著改变。其中,有 3 名患者应用氟西汀和哌甲酯,3 名患者应文拉法辛和哌甲酯,1 名只服用文拉法辛;哌甲酯为促醒剂,主要通过增加多巴胺和较小程度上增加去甲肾上腺素、5-羟色胺的释放和减少再摄取来改善睡意。文拉法辛为 5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRI),抗抑郁药中用于抗猝倒首选治疗方案。在低剂量时 SNRIs 抑制 5-羟色胺转运体,但随着剂量的增加,药物对去甲肾上腺素再摄取的影响更强。SNRIs也增加前额叶皮层多巴胺的释放由于抑制去甲肾上腺素转运体,这不仅对去甲肾上腺素再摄取影响还对多巴胺再摄取有影响。氟西汀为选择性 5-羟色胺再摄取抑制剂(SSRIs),主要通过抑制中枢神经对 5-羟色胺的再摄取来缓解猝倒,对去甲肾上腺素再摄取抑制作用较小,但比需要控制抑郁情绪水平要求更高的剂量,可能因为它的抗猝倒作用是由去甲肾上腺素促进代谢物去甲氟西汀介导。
..........
参考文献(略)
