本文是一篇临床医学论文,本研究通过收集2016年1月-2022年12月就诊于陕西省肿瘤医院的136例接受放疗的Ⅳ期肺腺癌患者的病理及临床资料,进行数据分析,评估影响患者预后的相关因素,及放疗长期生存患者的临床特征;探讨驱动基因不同状态时放疗对患者生存的影响,旨在为临床医生选择治疗方案及判断疾病预后提供参考。
1 NSCLC的流行病学特征及危险因素
1.1 流行病学特征
据世界卫生组织IARC的GLOBOCAN项目估计,2022年全球肺癌新发病例约250万例,占所有癌症病例的12.4%,是全球最常见的癌症类型,也是全球癌症死亡的主要原因(占所有癌症死亡的18.7%),且男性肺癌发病率和死亡率是女性的2倍[1]。这可能与男性吸烟率较高以及暴露于职业致癌物的机会更多有关。而近年来女性肺癌的发病率迅速上升,虽然烟草也是主要的风险因素,但中国女性吸烟率极低,仅为2.7%,这提示可能存在其他因素影响女性肺癌的发生,如环境因素(如职业相关、空气污染、厨房油烟等)、遗传因素、激素和生殖因素等[10, 11]。
年龄分布显示,男性50岁后肺癌新发及死亡数均居首位,女性60岁后肺癌发病达高峰,但50岁起肺癌与消化道癌共同成为主要死因[12]。一项回顾性队列研究显示,肺癌发病的平均年龄为60.96岁,呈现两个发病高峰年龄段:50-59岁组和60-69岁组,提示50岁以上中老年群体是肺癌的高发人群[13]。
..............................
1.2 危险因素
吸烟是肺癌最重要的危险因素,其与鳞癌和SCLC的关系相对更为密切。吸烟者肺癌发病及死亡风险较非吸烟者显著升高,且呈现剂量-反应关系:吸烟起始年龄越早、每日吸烟量越多、吸烟持续时间越久肺癌发病的相对风险就越大[14]。戒烟可使肺癌发病风险降低,但与不吸烟者相比患肺癌风险仍高[15]。与男性相比,女性对烟草致癌物更敏感,不仅女性吸烟者较同龄男性患肺癌风险更高,且非吸烟女性暴露于二手烟的肺癌风险也更高[16]。Hori等[17]对二手烟与肺癌之间的关系进行了系统评价和荟萃分析,结果显示环境烟草烟雾暴露与女性肺癌风险显著相关。值得注意的是,长期接触高温烹饪所产生的厨房油烟可诱导DNA损伤或癌变,成为非吸烟女性患肺癌的重要致病因素之一[14]。
环境因素也不容忽视,长期接触石棉、氡、砷、铬、金属、电离辐射等致癌物暴露的职业人群,肺癌的发病率明显增加[18, 19]。另外,二氧化硅也是明确的肺癌致癌物[20]。
遗传因素在肺癌的发病中也起着重要作用,有肺癌家族史的人群可能存在遗传易感位点,因此家族中有肺癌患者的个体,其肺癌发病风险明显升高[21, 22]。Frank等[23]研究证实在一级亲属中发现肺癌,父母和子女之间的相对风险(relative risk,RR)为1.9,兄弟姐妹之间的RR为2.5。
女性肺癌的性别特异性发病机制与性激素代谢密切相关,He等[24]研究表明,月经和生育史可能与肺癌的发生发展有关,雌激素具有致癌及促癌作用。同样也有研究者认为绝经年龄较晚、月经周期短等内源性雌激素暴露增加会显著提升中国非吸烟女性的肺癌风险[25]。
.............................
第二部分 136例接受放疗的Ⅳ期肺腺癌患者生存分析
1 临床信息资料
本研究通过病例系统详细整理了2016年1月-2022年12月就诊于本院的136例接受放疗的Ⅳ期肺腺癌患者的病理及临床资料。至随访截止时,69.1%(94/136)的患者死亡,30.9%(42/136)仍存活。基线特征分析如下:性别构成上,男性69例,占比50.7%,女性67例,占49.3%,男女比例接近1:1;年龄分布,≤60岁的患者相对较多,占比55.9%(76例),而>60岁共60例,占比44.1%;个人吸烟史中,无吸烟史者81例,占59.6%,有吸烟史者55例,占比40.4%;家族肿瘤史,119例(87.5%)患者无明确家族肿瘤史,17例(12.5%)患者存在家族聚集现象;在疾病确诊前,体重没有下降的患者共105例,占比77.2%,体重下降的患者共31例,占比22.8%;肿瘤形态构成显示,中央型病变41例,占比30.1%,周围型病变95例,占69.9%;组织学分级结果显示,低至中分化患者73例,占比53.7%,中至高分化37例,占27.2%,另有26例(19.1%)患者未能明确分级;转移模式分析表明,单器官转移37例,占27.2%,双器官转移52例,占比38.2%,多器官转移(≥3个)47例,占34.6%;临床分期分布为IVa期52例,占比38.2%,IVb期84例,占比61.8%;卡氏评分(KPS)≥70分者109例,占比80.1%,KPS<70分有27例,占比19.9%;从驱动基因状态看,驱动基因突变阳性率为70.6%(96/136),野生型占21.3%(29/136),还有8.1%(11/136)的患者基因突变未知;血液生物标志物,LIPI评分分层:好组33.8%(46/136),中间组45.6%(62/136),差组20.6%(28/136);全身免疫炎症指数(SII)≤604.1者占41.9%(57/136),SII>604.1者占58.1%(79/136);化疗方案应用情况,<4周期占24.3%(33/136),4-6周期占22.8%(31/136),>6周期占40.4%(55/136),未接受化疗者占12.5%(17/136);未接受靶向治疗的患者共51例(37.5%),接受的有85例(62.5%);
........................
2 PFS和OS单因素分析
2.1 PFS单因素分析
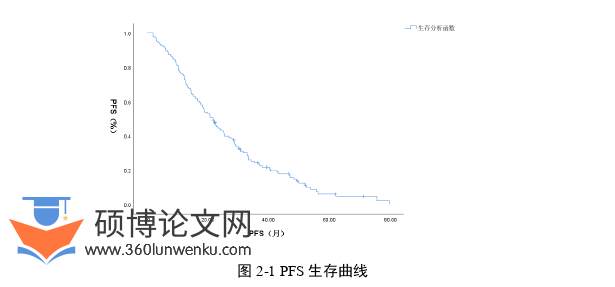
入组136例患者的中位无进展生存期(mPFS)为21.7个月(95%CI:18.022-25.378),1年、3年、5年PFS率分别为72.8%、23.5%、4.8%,生存曲线见图2-1。单因素生存分析显示,性别(P<0.001)、年龄(P=0.001)、吸烟史(P=0.002)、转移器官数目(P=0.001)、临床分期(P=0.005)、驱动基因状态(P<0.001)、靶向治疗(P<0.001)、治疗方式(P<0.001)与患者PFS相关,差异具有统计学意义。而家族史、确诊前体重是否下降、肿瘤形态、肿瘤分化程度、KPS评分、LIPI评分、SII、化疗周期、免疫治疗、放疗部位与患者PFS无明显相关性(P>0.05)。详情见表2-2。
临床医学论文怎么写
........................
第三部分 驱动基因阳性Ⅳ期肺腺癌预后分析 ..................... 36
1 驱动基因类型与生存分析............................. 36
2 EGFR突变类型与生存分析 ................................ 36
第四部分 驱动基因阴性Ⅳ期肺腺癌预后分析 ................. 41
1 胸部原发灶放疗对生存的影响 ................................ 41
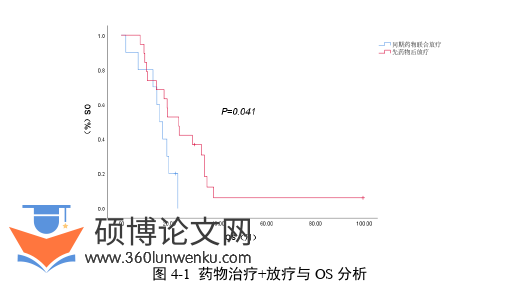
2 药物治疗+放疗对生存的影响 .................................. 41
第五部分 讨论.................................. 43
1 Ⅳ期肺腺癌患者总体预后 ................................ 43
2 转移器官数量及放疗剂量对预后的影响 ........................ 44
第五部分 讨论
1 Ⅳ期肺腺癌患者总体预后
Cui等[90]荟萃分析显示,免疫检查点抑制剂联合放化疗对Ⅳ期NSCLC患者安全有效,ORR为39.9%,1年PFS和OS分别为27.9%和72.2%。贾杨洋等[91]回顾性分析152例Ⅳ期肺腺癌患者的临床资料,接受一线系统治疗(包括含铂类化疗、分子靶向治疗、免疫治疗和抗血管生成药物治疗)联合局部强化治疗(手术、放疗、消融)的患者中位PFS为42.0个月,5年无进展生存率为38.5%;仅接受一线系统治疗的患者中位PFS为20.7个月,5年无进展生存率为23.2%,结果显示系统治疗联合局部强化治疗的患者PFS显著延长(P<0.05),5年生存率也明显提高(73.5%vs.57.3%,P<0.05)。另外最近的一项[92]Ⅲ期临床研究结果显示,转移性NSCLC患者靶向治疗联合放疗的中位PFS为17.1个月、中位OS为34.4个月。本研究中全部患者的中位PFS为21.7个月(95%CI:18.022-25.378),1年、3年、5年PFS率分别为72.8%、23.5%、4.8%;中位OS为31.0个月(95%CI:25.609-36.391),1年、3年、5年OS率分别为82.4%、42.6%、21.7%,与上述研究基本相符。
临床医学论文参考
............................
结论
1.生存分析显示,年龄、转移器官数目、是否靶向治疗是影响Ⅳ期肺腺癌患者PFS的独立预后因素;转移器官数目、LIPI评分、放疗部位是影响Ⅳ期肺腺癌患者OS的独立预后因素。
2.临床分期和LIPI评分是影响Ⅳ期肺腺癌放疗长期生存患者的独立预测因素。
3.接受放疗的驱动基因阳性Ⅳ期肺腺癌患者中,KRAS突变阳性的患者预后相对较差,与KRAS突变相比EGFR突变阳性的患者预后较好;接受胸部原发灶放疗的患者生存期显著延长;放疗联合靶向治疗优于同期或序贯放化疗;在靶向治疗的基础上放疗晚干预可以降低复发风险。
4.接受放疗的驱动基因阴性Ⅳ期肺腺癌患者中,可考虑先全身药物治疗,药物治疗有效、疾病稳定时加入放疗。
参考文献(略)
