本文是一篇临床医学论文,本研究通过系统观察UMSC-Exos在APP/PS1双转基因小鼠模型中的作用,验证了其作为一种潜在治疗工具的显著效果及多维机制。
1材料
1.1实验动物
9月龄APP/PS1双转基因雄性小鼠和年龄匹配的C57BL/6雄性小鼠,均处于特定不携带病原体(SPF级)的条件下进行饲养,所需实验小鼠均购自北京华阜康生物科技股份有限公司。
临床医学论文怎么写
..........................
1.2实验细胞及外泌体
1.2.1脐带间充质干细胞
从健康足月分娩的胎儿中获取脐带组织,进行分离培养得到脐带间充质干细胞。
1.2.2脐带间充质干细胞外泌体
从脐带间充质干细胞的上清液中进行一系列离心方法分离获取UMSC-Exos。
.....................................
2方法
2.1 AD动物模型的构建及分组
9月龄APP/PS1双转基因雄性小鼠和年龄匹配的C57BL/6雄性小鼠,均购自北京华阜康生物科技股份有限公司。每只小鼠重量约为25-30g,小鼠被分组分笼饲养(每笼3-5只)。实验开始前,所有动物均在特定无病原体(SPF级)条件下饲养,并在实验室环境中适应2周。饲养环境控制为温度22℃-24℃、湿度50-60%,光照条件为12小时光/暗循环。动物可自由摄食标准实验室饲料和饮用水。实验中将实验动物分为3组(每组n=10):WT组、APP/PS1+Veh组及APP/PS1+Exos组。
.......................
2.2 UMSC-Exos的提取与鉴定
根据西安市人民医院(西安市第四医院)伦理委员会(20230040)批准方案及美国国立卫生研究院指南进行实验。首先从西安市人民医院妇产科的3名健康待产母亲(年龄25-30岁)中收集脐带组织。脐带的排除标准包括存在已知的急性或慢性疾病、遗传性病、传染病、高血压、高血糖、胎儿先天性疾病、妊娠相关并发症、服用药物、年龄小于22岁或大于32岁,实验开始前均已签署相关捐献知情同意书。
............................
3 结果 ........................................... 21
3.1 UMSC-Exos 的鉴定及脑内示踪 ................................... 21
3.2 UMSC-Exos 降低 Aβ负荷并修复 BBB 的完整性 ................... 22
3.3 UMSC-Exos 激活 Ang1/Tie2 信号通路并促进新生血管生成 . 27
4 讨论 .............................. 37
4.1 UMSC-Exos 对 Aβ清除和 NVU 保护的作用 .......................... 38
4.2 激活 Ang1/Tie2 通路修复 BBB 稳定性的机制意义 ............... 39
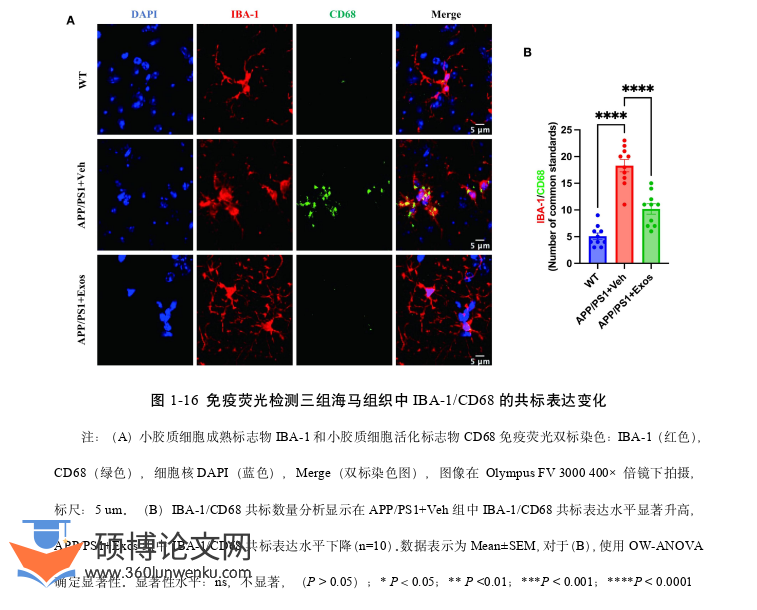
4.3 UMSC-Exos 的抗神经炎症作用与其机制意义 ........................... 39
结论 ........................... 42
4讨论
4.1 UMSC-Exos对Aβ清除和NVU保护的作用
Aβ斑块被认为是导致神经元损伤和认知功能下降的主要原因[96-97],也是AD最早的病理特征之一[98],其沉积部位主要在与认知和记忆相关的重要区域-海马[99]。研究表明Aβ神经毒性可导致突触损伤、氧化应激、炎症、神经元变性和BBB损伤,从而影响记忆和学习能力[100]。因此,Aβ的清除能力直接影响AD的病程进展,其表达水平降低是评价AD病情好转的重要指标。本研究通过Western Blotting和免疫荧光实验验证了UMSC-Exos能够显著降低APP/PS1小鼠海马区域的Aβ负荷(图1-4图1-5)。这一作用可能与UMSC-Exos促进Aβ的代谢和转运有关。已有研究表明,干细胞来源外泌体通过递送特定的miRNA和蛋白质,能够调控Aβ的降解和清除通路[101]。
除此之外,本研究进一步发现AD中NVU的功能障碍是限制Aβ清除的重要因素。NVU是由包括内皮细胞在内的血管细胞、神经元和神经胶质细胞组成的功能结构。Aβ的清除率与NVU密切相关,尤其是内皮细胞。在NVU中,内皮细胞与周细胞、神经胶质细胞、神经细胞和免疫细胞协调,以维持BBB的完整性,并调节大脑中的血管结构和功能[101]。BBB主要由内皮细胞、周细胞、星形胶质细胞、紧密及粘附连接复合体组成[102]。内皮细胞被认为是BBB的核心结构,CD31是其主要标志物,内皮细胞间的紧密连接靠其固定形成不同的空腔和空腔外膜室。由于周细胞的贴壁作用,内皮和周细胞之间通过血小板源性生长因子β/血小板源性生长因子β受体信号通路紧密联系[103-104]。紧密连接在维持渗透屏障和组织稳态中起核心功能[105],ZO-1和Occludin是主要的紧密连接蛋白,两者确保连接的密闭性。当NVU的核心组成部分BBB发生损伤,特别是内皮细胞功能下降会导致Aβ的清除效率显著降低,同时加剧脑内毒性物质的积累。在我们的研究中,UMSC-Exos通过修复NVU的功能,显著提高了紧密连接蛋白(ZO-1和Occludin)的表达水平及(CD31/ZO-1和CD31/Occludin)共标表达水平,改善了BBB的完整性和功能(图1-6图1-7图1-8)。
临床医学论文参考
.............................
结论
AD是严重威胁全球老龄化人群健康的神经退行性疾病,其特征性的病理改变包括Aβ沉积、BBB功能障碍、神经炎症以及认知功能显著衰退。尽管大量研究致力于探讨AD的病理机制及干预策略,目前尚无能够延缓或阻止疾病进程的有效治疗方法,这使得寻找创新性、多靶点的治疗手段尤为重要。
本研究通过系统观察UMSC-Exos在APP/PS1双转基因小鼠模型中的作用,验证了其作为一种潜在治疗工具的显著效果及多维机制。通过我们的研究表明,UMSC-Exos能够通过多机制协同作用,显著改善AD小鼠的多重病理。主要包括以下几点:1)减少Aβ负荷以缓解其神经毒性;2)修复NVU功能以促进Aβ转运和BBB稳定;3)激活Ang1/Tie2信号通路以实现血管稳态的重建;4)抑制神经炎症,从而保护脑微环境;5)促进APP/PS1小鼠认知功能的恢复。以上结果表明UMSC-Exos在神经保护、血管修复及炎症调控中具有广泛潜力。
不仅如此,本研究还进一步完善了UMSC-Exos对AD作用机制的认识,尤其是UMSC-Exos通过Ang1/Tie2信号通路介导BBB修复与功能优化的关键作用。尽管本研究从多个角度证实了UMSC-Exos在AD模型中的疗效及作用机制,其临床推广应用仍面临一些挑战,例如UMSC-Exos的关键生物活性成分以及与其他病理信号通路的交互作用尚未完全明确。此外针对其长期安全性、治疗有效剂量及递送策略的优化仍需进一步探讨。未来的研究应结合功能性成分解析、高效递送系统开发和临床研究中的多中心验证,以全面评估UMSC-Exos在AD治疗中的潜能。
参考文献(略)
