第一章 绪论
1.1引言
二氧化硅化学在基础科学、技术和工业中具有十分广泛的应用,是溶胶-凝胶化学中非常重要的一个分支。在二氧化硅化学的领域中,硅基介孔材料获得了众多科研工作者的密切关注与广泛研究。硅基介孔材料通常指骨架主要由 Si、O 组成的材料,根据其内部组分和结构的不同,硅基介孔材料主要分为四类:纯硅基的介孔材料、有机-无机杂化的介孔材料,介孔氧化硅基的复合介孔材料以及杂原子取代的介孔材料。介孔纳米材料尺寸接近电子的相干长度与光的波长,具有大的表面积,因此展现出一些如量子尺寸效应、小尺寸效应、表面与界面效应以及宏观量子隧道效应等独特的性质,近年来,介孔纳米材料一直是材料领域研究的热点。
介孔氧化硅纳米材料不仅继承了硅基介孔材料和纳米材料的双重特征,而且具备较大的比表面积,有序的介孔结构,较大的孔容以及较宽可调控的孔径分布(2-50 nm),随着广大科研工作者对介孔氧化硅纳米材料的不断开发,介孔氧化硅纳米材料逐渐在许多重要的研究领域如气体和分子吸附[3, 4],催化[5],药物和基因传递[6-11],电子和传感等领域[12]展现了十分广阔的应用前景。
介孔氧化硅纳米材料主要包括纯无机-Si-O-Si-结构的介孔氧化硅纳米材料以及有机-无机掺杂的介孔有机氧化硅纳米材料。自 1992 年 Mobil 公司成功地合成了 MCM-41 系列介孔材料以来,掀起了介孔纳米材料的研究热潮[13-16];随后,在 1999 年,Stein[17],Inagak[18]以及Ozin[19]课题组分别独立地完成了在介孔氧化硅材料的骨架中掺杂了有机基团的工作,自此,有机-无机杂化介孔有机氧化硅纳米材料的研究取得了长足的发展。
与介孔二氧化硅纳米粒子(MSNs)类似,介孔有机氧化硅纳米颗粒(MONs)不仅具有典型可控的介孔结构[20],包括较高的比表面积,较大的孔容以及可调的孔径分布,同时由于有机基团的引入,极大地改善了 MONs 的生物相容性,如降低了材料的溶血活性、细胞毒性以及改善了材料的生物的可降解能力等[2],另外,有机基团的加入也增加了主客体之间的相互作用,提高了纳米颗粒对药物、客体分子、蛋白等的装载能力,实现了对载体的可控缓释;最重要的是,通过调整有机基团掺杂的种类与数量,可赋予 MONs 纳米粒子各种卓越的性质与更加强大的功能,比如通过调整 MONs 材料中掺杂的有机基团的种类与比例,既可以对其孔道的亲水/疏水性进行有效调整[21],
对目标药物进行更有效的装载,亦可使其实现特异性微环境响应型分解[22, 23],理论上讲,这种纳米材料的孔壁化学性质的多样性是无限的。因此,介孔有机氧化硅的新材料与新功能具有很强的开发潜力,与此同时,挖掘介孔有机氧化硅的新材料与新功能对未来介孔有机氧化硅在纳米生物医学中的应用以及临床转化具有重要的战略意义和价值。
..........................
1.2介孔有机氧化硅(MONs)合成机理
关于如何明确定义介孔有机氧化硅纳米材料一直是一个具有争议性的问题,一般认为掺杂了有机氧化硅骨架的介孔氧化硅就是介孔有机氧化硅,包括部分有机氧化硅掺杂的无机-有机杂化以及完全的有机氧化硅骨架的介孔有机氧化硅纳米颗粒[20, 24, 25](如图 1.1)。MONs 的形成主要包含两个部分,其一便是胶体粒子的形成,其二便是介孔孔道的塑造。
![图 1.1 (a)纯无机骨架组成的 MSNs 颗粒, (b)部分掺杂的有机-无机骨架组成的杂化 MONs, (c)完全的有机基团骨架的 MONs[26]。](/uploads/allimg/200308/2696-20030R142592U.png)
1.2介孔有机氧化硅(MONs)合成机理
关于如何明确定义介孔有机氧化硅纳米材料一直是一个具有争议性的问题,一般认为掺杂了有机氧化硅骨架的介孔氧化硅就是介孔有机氧化硅,包括部分有机氧化硅掺杂的无机-有机杂化以及完全的有机氧化硅骨架的介孔有机氧化硅纳米颗粒[20, 24, 25](如图 1.1)。MONs 的形成主要包含两个部分,其一便是胶体粒子的形成,其二便是介孔孔道的塑造。
![图 1.1 (a)纯无机骨架组成的 MSNs 颗粒, (b)部分掺杂的有机-无机骨架组成的杂化 MONs, (c)完全的有机基团骨架的 MONs[26]。](/uploads/allimg/200308/2696-20030R142592U.png)
1.2.1 胶体粒子的形成
介孔氧化硅纳米颗粒以及介孔有机氧化硅纳米颗粒的形成,一般都需经历溶胶-凝胶的过程,在这个过程中,主要包含硅烷的水解和缩合两类反应,例如在经典的 St?ber 方法合成介孔氧化硅纳米颗粒的过程中,四乙氧基硅烷(TEOS)首先发生水解,产生不同羟基数量(x=1-4)的硅醇水解产物(反应方程式 1.1),而后在氨水的催化作用下,硅醇与硅醇或硅醇与未水解的 TEOS 发生缩合反应(反应方程式 1.2~1.3),
介孔氧化硅纳米颗粒以及介孔有机氧化硅纳米颗粒的形成,一般都需经历溶胶-凝胶的过程,在这个过程中,主要包含硅烷的水解和缩合两类反应,例如在经典的 St?ber 方法合成介孔氧化硅纳米颗粒的过程中,四乙氧基硅烷(TEOS)首先发生水解,产生不同羟基数量(x=1-4)的硅醇水解产物(反应方程式 1.1),而后在氨水的催化作用下,硅醇与硅醇或硅醇与未水解的 TEOS 发生缩合反应(反应方程式 1.2~1.3),
形成寡聚或者多聚硅氧烷化合物,寡聚或者多聚硅氧烷化合物网络进一步扩展,或者寡聚硅氧烷化合物的聚集便会导致 SiO2纳米颗粒的成核与生长。
...........................
第二章 柔性介孔有机氧化硅纳米棒的制备及其细胞吞噬
2.1引言
纳米粒子(NPs)在各种生物医学中的应用研究引起了日益广泛的关注,包括但不仅仅局限于生物成像[20, 24, 79, 80]、药物/基因递送[6-11]和肿瘤治疗[44, 81-84]。纳米粒子理化性质在其与细胞相互作用及其在体内活动等生物学行为中发挥着重要作用[44-47]。过去的研究表明,纳米粒子的几何参数(如尺寸和形状)[29-35]、表面性质(例如电荷、配体类型和密度)[32, 48, 49],[50, 51]、和粒子成分(例如脂质体、金属和无机-有机杂化物)[1, 2]对生物-纳米相互作用过程(包括细胞摄取、肿瘤累积和生物分布)有着很大的影响。
2.2 实验部分
2.2.1 硬 GNR@MON/PEI 的制备
将 0.08 g CTAB 溶于水(37.5 mL)、无水乙醇(15 mL)和浓氨水(0.5 mL, 25-28 wt.%)的混合物中。溶液在 35℃下搅拌(1100 rpm) 15 分钟。然后,将 10 mL 制备好的 GNRs 加入混合溶液中。搅拌 1h 后,加入 BTSE (0.1 mL)、TEOS (0.1 mL)和 APTES (0.01 mL)的混合硅烷前驱体,在 35℃的剧烈搅拌(1100 rpm)下搅拌 1 min。24 h 后,制备的金纳米棒包有机氧化硅纳米粒子 (GNR@MON)通过 8000 rpm 离心 20 min,乙醇洗涤 5 次后,在含有浓盐酸(200 μL, 37%)和乙醇(100 m L)的溶液中通过三次溶剂萃取除去 CTAB 表面活性剂。用乙醇洗涤三次后,将最终沉淀物再分散于 25 mL 乙醇中备用。然后,取已经制备的 5 mL 的 GNR@MON 溶液,以 8000 rpm 离心,离心 20 min,水洗一次,再分散于 PEI 水溶液中(2 mg/mL)。将硬棒 GNR@MON/PEI在室温下摇晃 12 小时后,用水冲洗一次,然后分散在 5 ml 水中备用。
第二章 柔性介孔有机氧化硅纳米棒的制备及其细胞吞噬
2.1引言
纳米粒子(NPs)在各种生物医学中的应用研究引起了日益广泛的关注,包括但不仅仅局限于生物成像[20, 24, 79, 80]、药物/基因递送[6-11]和肿瘤治疗[44, 81-84]。纳米粒子理化性质在其与细胞相互作用及其在体内活动等生物学行为中发挥着重要作用[44-47]。过去的研究表明,纳米粒子的几何参数(如尺寸和形状)[29-35]、表面性质(例如电荷、配体类型和密度)[32, 48, 49],[50, 51]、和粒子成分(例如脂质体、金属和无机-有机杂化物)[1, 2]对生物-纳米相互作用过程(包括细胞摄取、肿瘤累积和生物分布)有着很大的影响。
软硬度,作为纳米颗粒新近被探索的一个理化参数,由于其对生物-纳米系统独特的作用,日益在生物医学领域获得关注[1, 32, 85-88]。Hui 等人发现柔性二氧化硅纳米胶囊与硬质纳米胶囊相比,在三维肿瘤球体中具有更深的肿瘤穿透性和更高的肿瘤积累效率[85]。Caruso 等人和同事证明,与硬度较高的胶囊相比,较软的透明质酸胶囊具有更强的与细胞表面结合的能力和更快的细胞摄取。Guo 等人的研究表明,可以通过改变纳米材料的柔软性来改变其细胞内化途径[86]。这些工作表明柔性的纳米粒子确实在生物-纳米相互作用中具有优越的性质。然而,以往报道的柔性纳米粒子一般都是球形的或类球形的,这限制了对生物纳米系统中软纳米粒子的形貌效应的进一步研究。此外,以往报道的软纳米粒子通常没有明确的介孔[56],限制了药物分子的装载量。据我们所知,非球形柔性介孔纳米粒子的合成仍然是一个很大的挑战。
在此,我们采用分散保护刻蚀的方法制备了以金等离子激元为核,聚乙烯亚胺(PEI)为保护层(GNR@SMON/PEI)的柔性介孔有机氧化硅纳米棒,其中金纳米棒(GNR)作为几何形态调控的模板,PEI 作为高分散颗粒的保护层。柔性 GNR@SMON/PEI 具有棒状的形貌,且尺寸均一(174×105 nm),表面皱缩,内部腔大。此外,柔性 GNR@SMON/PEI 柔性纳米棒具有均匀的介孔(3.9 nm)、高的比表面积(355 cm2/g)和较大的孔容(0.35cm3/g)。更重要的是,柔性 GNR@SMON/PEI 的杨氏模量(120.2 MPa)明显低于硬质 GNR@SMON/PEI(361.4 MPa)。随后,在用透明质酸(HA)改性后,柔性 GNR@SMON/PEI-HA 的溶血率极低(2.36 %),拥有良好的生物相容性。血常规、血液生化及主要器官苏木精-伊红(H&E)染色表明,GNR@SMON/PEI-HA 具有较好的体内生物相容性。
..........................
..........................
2.2.1 硬 GNR@MON/PEI 的制备
将 0.08 g CTAB 溶于水(37.5 mL)、无水乙醇(15 mL)和浓氨水(0.5 mL, 25-28 wt.%)的混合物中。溶液在 35℃下搅拌(1100 rpm) 15 分钟。然后,将 10 mL 制备好的 GNRs 加入混合溶液中。搅拌 1h 后,加入 BTSE (0.1 mL)、TEOS (0.1 mL)和 APTES (0.01 mL)的混合硅烷前驱体,在 35℃的剧烈搅拌(1100 rpm)下搅拌 1 min。24 h 后,制备的金纳米棒包有机氧化硅纳米粒子 (GNR@MON)通过 8000 rpm 离心 20 min,乙醇洗涤 5 次后,在含有浓盐酸(200 μL, 37%)和乙醇(100 m L)的溶液中通过三次溶剂萃取除去 CTAB 表面活性剂。用乙醇洗涤三次后,将最终沉淀物再分散于 25 mL 乙醇中备用。然后,取已经制备的 5 mL 的 GNR@MON 溶液,以 8000 rpm 离心,离心 20 min,水洗一次,再分散于 PEI 水溶液中(2 mg/mL)。将硬棒 GNR@MON/PEI在室温下摇晃 12 小时后,用水冲洗一次,然后分散在 5 ml 水中备用。
为了修饰柔性 GNR@SMON/PEI 和硬棒 GNR@MON/PEI 上的 HA,首先用 GA 对纳米颗粒上的外层 PEI 骨架稳定性进行了增强。简而言之,将 5 m L 的 GNR@SMON/PEI 或GNR@MON/PEI 再分散于 5 mL 水中,与 5 mL GA 混合(0.025%水溶液)。在室温下振荡 12 h后,GA 与 PEI 在纳米颗粒上交联。产品经三次水洗后,再分散于 5 mL 水中备用。随后,将25 mL HA(水中 10 mg/mL)与 5 mL EDC (DMF 中 10 mg/mL)和 5 mL NHS (DMF 中 10 mg/mL)混合。将混合物在室温下振荡 3 小时以激活羧基。然后,将含羧基活化 HA 的溶液与 5 mL GA交联纳米颗粒混合。在室温下振荡 1 小时后,得到 HA 修饰的柔性 GNR@SMON/PEI (GNR@SMON/PEI-HA)和硬质对应物 GNR@MON/PEI-HA。产物用水冲洗两次,并分散在 5 m L 水中,以备进一步使用。利用 FITC 对 GNR@SMON/PEI-HA 和 GNR@MON/PEI-HA 进行进一步功能化,以探索它们的细胞吞噬效率。通常,5 mL 的纳米颗粒与 5 mL 的 FITC (0.1 mg/mL,无水乙醇溶液)混合。在黑暗环境中振荡 6 小时后,FITC 与纳米颗粒上的 NH2基团共价结合。最后用乙醇洗涤三次,分散在 5 ml 乙醇中。
..........................
..........................
第三章 介孔有机氧化硅纳米马达的水相合成及其性质研究................................. 33
3.1引言........................... 33
3.2实验部分......................................... 34
第四章 总结与展望...................................... 44
第三章 介孔有机氧化硅纳米马达的水相合成及其性质研究
3.1引言
微纳米马达是一种可以将其他形式的能量转化为机械能的微纳米器件。早期,研究者们通过把自然马达与人工合成的结构相互结合,以实现纳米粒子的制动调控,其中比较典型例子为,Montemagno 课题组将 F1-ATP 酶与镍纳米棒组装在一起,组成一个纳米螺旋推进器,在此体系中,F1-ATP 酶将 ATP 的能量转化为旋转扭矩,从而使得依托的纳米颗粒运动起来[97]。这些人工合成的纳米马达将外部的能量转化为微纳米尺度下作旋转[98]或者穿梭运动[99]的动能,这使得对微纳米尺度下有效、高效的运输活动的控制成为可能。这些开创性的工作极大地促进了微米马达[100]、纳米马达[101]的研究发展,微纳米马达在生物医学领域展现出了强劲的生命力与发展潜力,在纳米生物医学领域诸如药物运输[102]、用作细胞渗透工具[103]等方面发挥了重要的作用。
基于微纳米马达的重要性质与生物医学应用潜力,研究者们付出了诸多努力,开发了不同的纳米结构[104],包括不同材料[105, 106]、不同形状(管状[107]、不对称球形[100]以及不规则形状[108])的微纳米马达的构建,目前关于纳米马达构建的方法论内容并不丰富,采用的方法依然局限于:模板法、物理溅射沉积法、汽-液-固阵列生长法、高分子不对称结构水相合成法。模板法一般以多孔材料为模板,对孔道进行分步化学沉积,最后通过溶解模板而完成马达结构的构建,此法最大的局限性在于,所得马大结构的三维最大径向长度高达微米级别,目前尚未出现通过模板法制备尺寸小于 200 nm 的纳米级别马达;常用的物理溅射沉积法,需要经历样品铺板、溅射、洗脱、重分散等多个步骤,操作繁琐,且不易大量制备所需的微纳米马达结构,此法同样具有局限性;此外,汽-液-固阵列生长法与高分子不对称结构水相合成法对实验条件的控制比较严苛,想通过此类方法制备为纳米马达,并不容易。因此,寻找一种新的简单可靠的合成纳米马达的方法,不仅能够帮助丰富微纳米合成方法论的内容,对推进微纳米马达的进一步发展与应有具有非常重大的意义。
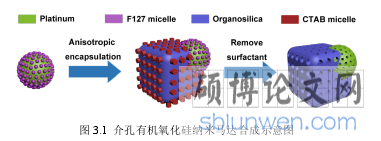
..........................

..........................
第四章 总结与展望
介孔有机氧化硅纳米颗粒(MONs)具有较高的比表面积,较大的孔容,可调的孔径分布以及较好的生物相容性,近年来在在生物医学中开发与应用得到了长足的发展,被广泛用于刺激性药物释放、靶向药物输送、基因运输和各种不同的其他治疗方式中。
基于 MONs 的优越性质和功能,本文主要探索了以 MONs 为基础的新型复合物纳米颗粒的合成方法及其生物医学性质,主要工作分为以下两个部分:
( 1 )柔性 GNR@SMON/PEI 具有更低的杨氏模量(120.2 MPa),皱缩形态以及大的内腔。此外,合成的 GNR@SMON/PEI 具有均匀的介孔(3.9 nm),高的比表面积(355 m2/g)和大的孔体积(0.35 μm3/g)。GNR@SMON/PEI 用 HA 功能化后,材料被赋予了优异的体外和体内生物相容性。最重要的是,与硬质的母体纳米颗粒相比,柔性GNR@SMON/PEI-HA 实现了 3 倍的细胞摄取效率,这为各种生物医学应用提供了一个充满希望的平台。
(2)基于 MONs 生长的条件,以水相合成方法,成功制备了介孔有机氧化硅纳米马达,这种介孔马达具有较大的比表面积(535.7 m2/g)、较高的孔容(0.62 m3/g)以及均匀的孔径分布(2.7 nm),另外,当加入双氧水后,介孔马达的运动由原来的“随机漫步”的模式转变为了具有指向性的运动模式,均方位移(MSD)数据统计结果显示,双氧水的加入显著提高了纳米马达的迁移扩散速率,另外,纳米马达表现出了对富含双氧水环境的运动趋向性,这些实验结果显示这种介孔有机氧化硅纳米马达对将来药物装载、分子运输、增强肿瘤组织颗粒渗透深度等工作中具有重要的应用价值和意义。
但是,鉴于研究生阶段时间有限,部分工作仍需进一步完善、增强,后续的研究工作可主要围绕以下几个方面展开:
(1)在活体层面探究,所制备的柔性介孔有机氧化硅纳米棒及其母体颗粒对血液循环时间、肿瘤富集量以及肿瘤组织渗透深度的不同影响于作用。
(2)验证纳米马达在肿瘤微环境双氧水存在的情况下是否有助于增强肿瘤细胞的吞噬效率,在活体层面探究纳米马达对肿瘤富集量以及肿瘤组织渗透深度的影响。
参考文献(略)
但是,鉴于研究生阶段时间有限,部分工作仍需进一步完善、增强,后续的研究工作可主要围绕以下几个方面展开:
(1)在活体层面探究,所制备的柔性介孔有机氧化硅纳米棒及其母体颗粒对血液循环时间、肿瘤富集量以及肿瘤组织渗透深度的不同影响于作用。
(2)验证纳米马达在肿瘤微环境双氧水存在的情况下是否有助于增强肿瘤细胞的吞噬效率,在活体层面探究纳米马达对肿瘤富集量以及肿瘤组织渗透深度的影响。
参考文献(略)
