第一章 绪论
1.1 选题背景与意义
世界卫生组织国际癌症研究机构(IARC)最新发布的癌症统计数据:2020 年全球新发癌症例数为 1929 万,死亡 996 万例[1]。这意味着每天大约有 5 万多名新发癌症病人,有近 3 万人死于肿瘤。我国是世界人口大国,也是癌症高发的国家。在 1929万新增病例及 996 万死亡病例中,我国新增病例数占 23.7%、死亡病例数占 30.1%,均居全球第一!如何实施系统的预防措施,降低癌症发病率和死亡率是亟待解决的问题。
肿瘤的形成需要经过一个漫长的周期。例如宫颈癌,从最初的原位癌生长到浸润癌需要经过 5-8 年的时间,甚至会长达 12 年[2]。这种较长的潜伏期,为早期癌症的检测提供了机会。随着医疗水平的进步,国内外已经在癌症治疗方面取得了一些突破性的进展,早期部分癌症的治愈率可以达到 85%以上[3]。然而,国际放射协会主席 Bruce Hillman 教授研究指出:常规的临床影像诊断方法,如 CT、MRI 等,无法检测出直径小于 5 毫米的早期肿瘤。因而在过去的几十年中,绝大多数癌症患者的 5 年生存率并没有明显增加[4]。
Weissleder 等人于 1999 年首次提出分子影像(Molecular Imaging, MI)的概念。它是利用影像技术来显示特定分子在活体状态下的变化,并在细胞和亚细胞水平进行定性及定量研究[5]。分子影像技术在癌症治疗方面的应用体现在:与常规的临床检测和基因检测技术不同,分子影像针对的是肿瘤细胞在分子水平发生的病态异常,这恰好介于基因技术与常规临床技术之间的空白领域,为肿瘤的早期检测提供了新思路[6-8]。
............................
1.2 X 射线发光断层成像研究现状
1.2.1 X 射线发光断层成像关键技术
作为一种新颖的成像方式,XLCT 采用特异性的纳米探针,结合精准的解剖结构信息和组织光学特性,同时构建准确的光传输模型与重建方法,通过采集到的生物体表面的光学信号分布,反演肿瘤体内探针受体的 3D 分布和量化信息。其研究的热点在于以下几个方面:
(1)光学探针。利用光学探针进行无创荧光成像是光学分子成像的优势之一,但现阶段存在临床可用的探针较少,光信号较弱及穿透深度有限等问题。XLCT 受到广泛关注得益于大量的光学探针的研究,这些探针被 X 射线激发能够具有单光子级的灵敏度[30]。
(2)量化分析。光源量化分析策略是克服光源重建不适定性、辅助重建算法进一步提高光源重建质量的有效手段,结合智能分析方法能够有效改善相邻较近的多个肿瘤组织的分辨,提升了成像结果的空间分辨率,为光学分子断层成像技术在复杂异质模型中的各种生物医学应用奠定基础[31]。
(3)成像设备。成像设备是 XLCT 的硬件研究基础,为了获得肿瘤特异性 3D 成像结果,需要借助成像设备采集生物体表面荧光信息与解剖结构信息[32]。
(4)光传输模型。生物医学光学中的光传输模型是利用可见光和近红外光对生物组织进行层析成像的基础,这些模型通过预测光强度,然后将其与组织边界上测量的光强度进行比较[33]。新型光传输模型的研究,不仅提高计算效率,而且提供了更高精度的解决方案,促进和提高光学图像重建的质量。
(5)光源重建算法。利用微小肿瘤空间分布的稀疏特性和测量数据的严重不充足性,创建融合稀疏正则化高稳定性的光学三维重建方法,确保原位复杂特殊环境下定量光学分子成像的精度稳定性,为微小肿瘤早期检测提供算法支撑[34]。
...........................
第二章 混合光传输模型研究
2.1 引言
X 射线发光断层成像(XLCT)基础从提出到现在已经广泛的应用于肿瘤早期检测、药物代谢研究等预临床领域。虽然,XLCT 有高灵敏度、高特异性、价格低廉、安全无创和使用便携等显著的优点,但是 X 射线激发纳米荧光探针发出的可见光在生物组织内存在严重的吸收和散射效应,且光子传播路径并不是直线传播,导致XLCT 重建效果和置信度还不足以像其他成像模态(CT、MRI、PET 等)应用到临床中,其重建理论有待进一步的提高。高效、准确的光传输模型是 XLCT 前向问题的重要研究内容,同时也是逆向光源重建的理论基础。
由于目前 XLCT 研究常用光学探针的发射光谱主要集中在 400-800nm 的近红外一区谱段,因此本章主要针对近红外一区的光传输模型进行了研究。其中在红光和近红外谱段,生物组织的吸收系数远远小于其散射系数,一般使用一阶球谐近似模型,即扩散方程近似(DE)模型,即可达到合适的重建精度;对于蓝紫光谱段,生物组织以光吸收为主,一阶球谐近似模型难以达到较好的效果,高阶简化球谐近似(SPN)模型能够有更好的建模精度。此外,如果需要进一步考虑生物不同组织器官的吸收散射特性,构建更加准确的光传输模型,混合光传输模型则是最理想的选择。而在混合光传输模型中,对于器官的精准分类是十分重要的。
.......................
2.2混合光传输模型
根据解剖结构的先验信息,生物体可以划分为多个主要器官组织,以小鼠为例,可以将其划分为心脏、肌肉、肺、胃、肝脏以及肾脏这六个主要器官。由于不同的器官中含有不同的血红蛋白、氧气以及水的比例,最终在吸收和散射方面表现出不同的特性[63]。因此,根据不同的分类标准,可以将器官分为不同的类别。目前常用的分类标准是根据吸收与散射系数的比值来确定的,当其大于某一阈值时,将其划分为一类,小于这一值时,归为另一类[47][49]。但是,对于阈值的选择并没有一个明确的定义,且不同实验中相差甚大。Chen 等人在 FMT 的研究中将其设置 10[64],而 Dehghani 等人在 BLT 中设为 40[65]。在实际应用中,由于 XLCT 采用 X 射线激发纳米荧光物(Eu3+,发光波长 610nm),其发光谱段与其他模态不同,所以在这一谱段下的分类标准是否适用仍未可知。
为了对组织进行精准的分类,本研究以每个单独器官组织为对象,分别采用 DE模型和 SP3 模型进行光在生物组织内传输的仿真。同时,将作为金标准的蒙特卡罗(MC)方法的结果作为标准结果[66],通过将 DE 和 SP3 下各组织的结果与 MC 方法进行比较,判断其是属于 DE 适用组织或是 SP3 适用组织。具体的实验过程及结果在2.5 及 2.6 中进行描述。结果表明,心脏、肝脏、肾脏和胃属于 SP3 适用的组织,而肌肉和肺则是DE适用的组织。这一分类结果将用于下一部分中混合光传输模型的构建。
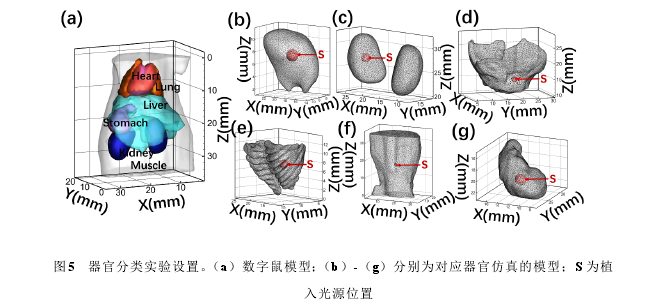
图5 器官分类实验设置。(a)数字鼠模型;(b)-(g)分别为对应器官仿真的模型;S 为植入光源位置
第三章 基于 Lasso-LSQR 的重建方法研究 ....................................... 27
3.1 引言 ...................................... 27
3.2 XLCT 光源重建概述 .............................................. 27
第四章 基于 ADMM-Net 的重建方法研究 ..................................... 41
4.1 引言 ................................................ 41
4.2 基于 ADMM-Net 的重建方法 ............................ 42
总结与展望 ....................................... 55
第四章 基于 ADMM-Net 的重建方法研究
4.1 引言
光学分子断层成像作为一种非接触、非电离的成像方式,在小动物预临床研究中发挥着重要作用。目前,光学分子成像在肿瘤精确成像、体内肿瘤生长监测、治疗监测等领域的应用和价值已经得到了广泛的关注。由于光源重建是一个不适定性问题,过去的数十年中,研究者们提出了一系列新颖的策略及算法,以实现更精确的光源重建。最初,采用 L2 范数正则化的重建方法来提高重建精度。然而,L2 范数的过平滑降低了重建图像的高频特征,最终导致重建图像中的目标模糊或扩散。随后,基于压缩感知理论和贪婪策略,开发了各种稀疏算法,包括采用稀疏正则化项(如 L0 和 L1等)进行优化等。
虽然通过各种高效的算法和策略对光学分子成像的性能进行了优化,但其精度仍然受到逆问题的病态性的限制。近几年机器学习的发展在光学分子成像方面显示出巨大的潜力,与传统方法不同的是,机器学习方法通过学习表面光信号与三维生物体内光源之间的映射关系,直接建模出光子的逆向传播过程。Guo 等人提出了一种用于荧光分子断层成像(FMT)的端到端三维深度编码解码器(3D-EnDecoder)网络,并在规则模型中实现了精确的重建结果[71]。它直接建立了荧光光源内部分布与荧光信号边界分布之间的非线性映射关系,从而从根本上避免了简化后的线性模型所带来的重建误差。Long 等人提出了一种基于两个阶段深度学习的三维重建算法,在第二阶段采用经过训练的三维卷积神经网络来细化 FMT 中第一阶段的原始荧光分布。开发了基于深度学习的两阶段三维重建算法,能够获得更少的伪影和更深位置的定位重建[72]。此外,Huang 等人提出了一种新的结合深度卷积神经网络、门控回归单元和多层感知的 FMT 重建方法(DGMM),能够使重建光源的定位更加准确[73]。DGMM 包括三个阶段:第一阶段,通过 VGG16 模型将测量到的表面光强编码为特征向量;第二阶段,利用基于 GRU 的网络将所有编码的特征向量融合为一个特征向量;最后,利用融合后的特征向量对荧光光源进行重建。为了提高切伦科夫发光层析成像(CLT)重建的精度和稳定性,Zhang 等人开发了新型多层全连接神经网络[74]。。这些令人激动的成果表明了机器学习在光学分子断层成像方面的巨大潜力[75]。
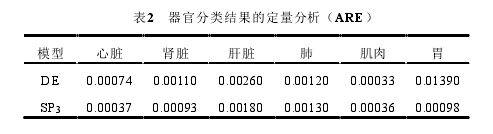
表2 器官分类结果的定量分析(ARE)
...............................
总结与展望
X 射线发光断层成像方法使用 X 射线作为激发方式,利用了一种完全不同的相互作用的方法来激发生物体组织中的纳米荧光探针,并对其进行检测以及定位。XLCT的生物学应用及目的是为了更好地了解组织的生理机能和病理生理学,为人类的生命健康提供保障是支撑 XLCT 不断发展进步的主要动力。但由于 XLCT 的求解过程是一个高度的病态性问题,生物组织解剖结构的复杂性、光在生物组织中传输时发生的各种效应的相互干扰、以及表面测量信号的有限性等,这些使 XLCT 在重建中的准确性、稳定性等方面仍面临着巨大的挑战。在 XLCT 中,精准快速的光传输模型和高效的光源重建算法是 XLCT 走向临床应用的必要条件。本文对此分别展开了相关研究,具体内容如下:
(1)在光传输模型方面:在辐射传输理论方面,以辐射传输方程(RTE)为基础,基于有限元求解框架,研究推导了扩散近似方程(DE)、三阶简化球谐波近似模型(SP3)以及混合 DE-SP3 模型的一般表达式、罗宾边界条件及融合边界条件后的稳态形式。同时研究针对不同器官对光的吸收散射特性不同的情况,分别采用 DE 和 SP3 方法对其进行实验分类,将这些组织分为 DE 适用组织及 SP3 适用组织。根据这一分类结果对所构建的混合 DE-SP3 模型的精度和效率进行了验证。数值仿真及在体实验结果表明:所提的混合 DE-SP3 模型在保持与 SP3 精度相当的情况下,效率比 SP3 提高了 3倍;同时针对 DE 在低散射、高吸收组织及近边缘情况下的局限性,混合 DE-SP3 模型也的效果也是最优的。
(2)在光源重建算法方面:研究针对传统的 L1 正则化重建算法在效率方面的不足,将基于贪婪方法的基追踪(BP)算法与基于凸优化方法的 L1 正则化算法进行结合,通过采用 LSQR 方法优化求解 Lasso 算法来有效的解决速度方面的问题,进一步提高重建结果的精度与速度。数值仿真及在体实验结果表明:Lasso-LSQR 算法在保证并提高精度的前提下,效率相比 BP 算法及采用 L1 正则化方法的 IVTCG 算法有明显的提高。
(3)在光源重建算法方面:针对传统基于模型重建方法参数选择问题,以及现有的基于机器学习方法的局限性,研究基于 ADMM 算法迭代求解子问题的过程,设计了一种深度学习的框架 ADMM-Net,旨在以网络的形式动态的学习算法中的各项参数。同时与现有的应用于光学分子成像方面的深度学习网络框架不同,研究所提的网络结构及内部求解过程均有理论支撑,可视化及可解释性也更强,此外 ADMM-Net方法对训练及测试过程中的数据维度没有限制,任意维度的数据均可进行,其泛化性更强。仿真结果表明:ADMM-Net 能够准确的重建出光源的位置,并且与真实光源的形态学相似度也更高。
参考文献(略)
