本文是一篇药学论文,本文从健康皮肤及皮炎皮肤取样进行金葡菌分离,并以分离得到金葡菌作宿主菌从环境水样中分离噬菌体,研究单一及混合噬菌体的抑菌效果。
1 绪论
1.1 皮炎与金黄色葡萄球菌
1.1.1 皮炎的特征与治疗
AD是一种慢性、反复发作的炎症性皮肤疾病,具有遗传、过敏与瘙痒等特征[1]。随着人们生活水平的变化及环境因素影响,如今AD在世界各国的发病率呈逐年上升趋势[2]。AD发病过程中伴有强烈瘙痒症状,易造成皮肤损伤,甚至严重的皮肤感染,这些症状会对患者的生活质量产生严重影响[3]。其发病机制与多种因素有关,如遗传、环境、免疫、神经及微生物等,主要的病理生理机制包含皮肤屏障功能障碍、皮肤微生态失衡与皮肤免疫微环境异常[4, 5]。AD多发于婴幼儿,其特征是出现严重的红斑、水肿、擦伤和浆液渗出,多位于面部/脸颊和躯干;儿童期由于反复搔抓,常累及屈肌表面,表现为红斑变白,干燥和皮肤增厚;青少年期AD表现为弥漫性,但也有局部病变,最典型的是手部、眼睑等部位;成人期表现为慢性手型AD或头颈型AD,常发于上躯干、肩膀和头皮[6-11]。
AD治疗的选择主要基于疾病严重程度,也取决于患者的年龄、合并症、依从性。对于轻、中度病例可进行润滑局部的基础治疗,以改善屏障功能紊乱;外用糖皮质激素和钙调磷酸酶抑制剂共同作为一线药用于AD治疗,当局部治疗无法控制时会采用短期光疗用于中、重度治疗,对于严重难治性病例则采用全身性治疗,如非特异性免疫抑制剂环孢素等;用抗生素治疗病原菌引起的继发感染[7-9, 12]。
.............................
1.2 噬菌体与噬菌体治疗
1.2.1 噬菌体的特征及分类
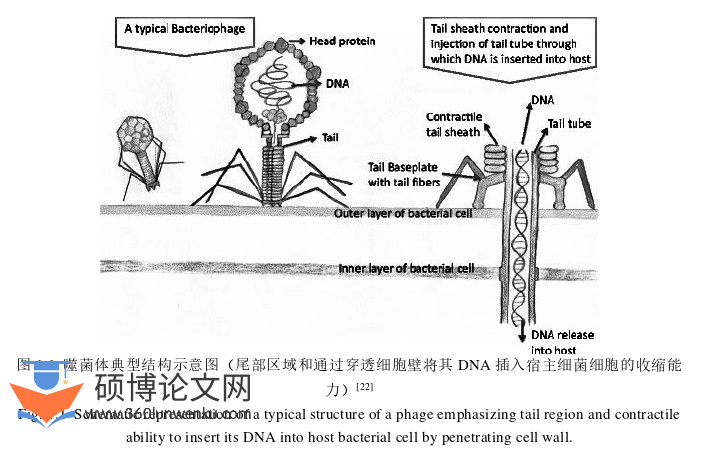
噬菌体是一类广泛存在于自然界中,能感染真菌类、细菌类、放线菌类和螺旋体等微生物的病毒总称,有研究表明噬菌体的数量远远超过细菌等微生物的总数[19]。噬菌体由蛋白质外壳和包被其中的核酸组成,无完整的细胞结构,个体微小,直径24-200 nm[20]。
1940年通过透射电镜首次将噬菌体的“真面目”公之于众,此后Bradley在1967年更详细地阐述了噬菌体的结构[21]。其中T4噬菌体是最大的噬菌体之一,长度约为200 nm,宽度约80-100 nm[22],其基本特征包括“头”或衣壳和“尾巴”(图1.1),附着在尾部的底板和尾部纤维,帮助噬菌体将自身附着在细菌细胞上[23]。
由于噬菌体在自然界中的数量庞大且体积及其微小,对其进行分类是一项艰巨的任务。1967年由Bradley首次分类并预测了六种基本的尾噬菌体形态类型,这些噬菌体进一步根据形态(收缩的尾、长尾和非收缩尾以及短尾)、丝状噬菌体、小等距ssDNA病毒和小ssRNA噬菌体进行分类;随后ICTV以更广泛的分类依据对噬菌体进行了分类,包括宿主范围、结构、衣壳大小和形状、基因组类型(单链/双链DNA或RNA)、基因组大小和对有机溶剂的耐受能力等[24]。随着检测技术的发展,噬菌体分类得到扩展,2015年ICTV对各噬菌体家族进行了汇编
药学论文参考
..........................
2 金黄色葡萄球菌分离鉴定及生物学特性研究
2.1 材料
2.1.1 菌株及来源
2020年10-12月期间,先后从10名20~40岁长住成都的健康成年人肘窝和36名某医院皮肤科收治并诊断为皮炎的患者患处皮肤采集样本,共46份皮肤样本。金葡菌菌株(S. aureus)SIIA1005来自国家新抗生素菌种保藏中心,MRSA菌株MRSA001由本实验室保存。
2.1.2 主要试剂及配制
卵黄亚碲酸钾、甘露醇发酵管、葡萄糖发酵管、冻干兔血浆、7.5%氯化钠肉汤培养基、B-P琼脂基础、甘露醇氯化钠琼脂培养基、血琼脂基础2号、MH肉汤、甲苯胺蓝-DNA酶琼脂培养基购自于青岛海博生物技术有限公司,MH琼脂、药敏纸片(抗生素)购自于杭州滨和微生物试剂有限公司,金牌Mix(green)、PCR扩增相关试剂和引物购自于北京擎科生物科技有限公司,标准革兰氏染色试剂盒购自于北京雷根生物技术有限公司,TaK aR a MiniBEST Bacteria Genomic DNA Extraction Kit、DL5000 DNA Marker购自TaK aRa,Ampicillin Sodium Salt、Kanamycin sulfate、4S Gelred核酸染料(10000×)购自于生工生物工程(上海)股份有限公司,Agar购自Biofroxx,Tryptone、Yeast Extract购自于OXOID。
培养基配制:
(1)7.5% 氯化钠肉汤培养基(1 L)
称取7.5% 氯化钠肉汤培养基90.00 g,加去离子水溶解后定容至1000 mL,每瓶100 mL分装至250 mL锥形瓶;121℃,15 min高压灭菌,再置于室温存放。
(2)B-P琼脂培养基(1 L)
称取B-P琼脂基础63.00 g,加去离子水溶解后定容至950 mL,每瓶95 mL分装至250 m L锥形瓶中;121℃,15 min高压灭菌,再置于室温存放。临用前加热融化,冷却至50℃左右,每瓶加入5 mL常温卵黄亚碲酸钾,摇匀后倒入无菌平皿。
........................
2.2 方法
2.2.1 金黄色葡萄球菌分离及形态鉴定
2.2.1.1 样品采集及选择性富集
将浸于无菌0.15 M NaCl和0.1% Tween20中的无菌棉拭子挤出多余液体,对10名20~40岁的健康青壮年的肘窝进行擦拭和36名确诊为皮炎的患者患处无破损的皮肤进行反复擦拭[40],将棉拭子放入装有2 mL 7.5%氯化钠肉汤培养基的无菌玻璃试管中,充分震荡后编号,37℃,220 r/min,振荡孵育培养24 h[41]。
2.2.1.2 分离及纯化培养
从24 h富集培养液中取1接种环,划线于B-P琼脂平板,倒置于37℃恒温培养箱中孵育24 h[42]。
挑取疑似单菌落在B-P琼脂平板上继续划线进行二次纯化,倒置于37℃恒温培养箱中孵育24 h。
2.2.1.3 革兰氏染色鉴定
在干净的载玻片上滴加1滴无菌水,用接种环挑取少量纯化菌落与无菌水混匀,用酒精灯外焰快速来回移动3-5次,每次1 s固定菌。按照标准革兰氏染色试剂盒说明书进行革兰氏染色。滴加香柏油后置于光学显微镜镜检。典型的金葡菌在显微镜下呈蓝紫色、排列成葡萄串状,直径约0.5-1.5 μm,属革兰氏阳性球菌[42, 43]。
.............................
3 金黄色葡萄球菌噬菌体分离鉴定及生物学特性分析......................27
3.1 材料......................................27
3.1.1 噬菌体来源及样品预处理................................27
3.1.2 主要试剂及耗材.....................................28
4 多联噬菌体体外抗菌活性研究.................................45
4.1 材料.............................................45
4.1.1 噬菌体及菌株来源..........................45
4.1.2 主要试剂........................................45
5 总结与展望.....................................57
5.1 总结.....................................57
5.2 展望...............................................58
4 多联噬菌体体外抗菌活性研究
4.1 材料
4.1.1 噬菌体及菌株来源
6株候选噬菌体来源于章节3.3.7所选的噬菌体。 金葡菌株来源于章节2分离纯化并保存的9株耐药金葡菌,MRSA菌株MRSA001由本实验室保存。 本实验室保存的7株葡萄球菌:S. warneri 1D,S. simulans 2A/4D,S. epidermidis 2B/3B,S. pasteuri 6C,S. haemolyticus 10C。
4.1.2 主要试剂
1600 μg/mL(100×R)万古霉素5 mL:称取0.0080 g万古霉素,1 mL超纯水溶解并定容至5 mL,0.22 μm过滤除菌,无菌水稀释至使用浓度。
3200 μg/mL(100×R)头孢呋辛酯5 mL:称取0.0160 g头孢呋辛酯,用DMSO(20%终浓度)溶解,0.1mol/L磷酸盐缓冲液(pH6.0)定容至5 mL,0.22 μm过滤除菌,使用0.1 mol/L磷酸盐缓冲液(pH6.0)稀释至使用浓度。 其余所用到的试剂及培养基配制方法见章节2.1.2。
稳定剂配制:
(1)1.6 M D-海藻糖:称取D-海藻糖60.53 g,用去离子水加热溶解并定容至100 mL,121℃,15 min高温高压灭菌;置于室温保存。
(2)1.6 M 蔗糖:称取蔗糖54.77 g,用去离子水加热溶解并定容至100 mL,121℃,15 min高温高压灭菌;置于室温保存。
(3)30%甘油(w/v):称取丙三醇(甘油)30.0 g,用去离子水溶解并定容至100 mL,121℃,15 min高温高压灭菌;置于室温保存。
pH 精密试纸(5.5-9.0)购自上海三爱思试剂有限公司。
药学论文怎么写
..........................
5 总结与展望
5.1 总结
本研究通过分离纯化分别获得了金葡菌和金葡菌噬菌体,主要研究结果如下:
(1)分离纯化获得葡萄球菌90株。经形态鉴定、表型鉴定、生化鉴定和16S测序鉴定,最终确定分离获得9株金葡菌,且均来自皮炎组样本。分别对这9株金葡菌进行spa分型、毒力基因检测、抗生素耐药性测试,结果显示被分成9种不同的spa类型,所携带的杀白细胞素基因pvl和粘附因子基因clfa携带率为100%,所有分离金葡菌均对至少1种测试抗生素具有耐药性,其中对头孢呋辛酯可达到89%的耐药率,其次为氨苄青霉素耐药(56%)。
(2)从9处不同环境来源水样分离纯化获得27株金葡菌噬菌体。以10株金葡菌作宿主菌,分别从9处环境水样中分离纯化获得27株噬菌体;测定27株噬菌体对11株金葡菌的裂解范围,为同时抑制10株耐药金葡菌,最终选取6株总裂解谱覆盖所有测试菌株的噬菌体作为混合噬菌体的候选噬菌体。根据电镜图像可将6株候选噬菌体归类到Caudovirales(尾病毒目)的Myoviridae(肌病毒科)家族,且噬菌体核酸链型均为dsDNA,主要结构蛋白分子量约50 kDa。6株噬菌体在低于40℃均表现出良好的稳定性,但高于50℃时6株噬菌体均表现出部分失活;pH介于7.0±2.0时6株噬菌体均稳定,其中2株噬菌体(5-9和39-2)的pH稳定性范围最宽,在5.0-12.0范围内具有良好的稳定性,总体而言,6株噬菌体更耐碱而不耐酸。
(3)6种配伍的多联噬菌体抑菌效果优于抗生素。鉴于6株单噬菌体并不能分别对10株耐药金葡菌同时起到很好的抑菌效果,根据单一噬菌体分别对10株耐药金葡菌的最佳抑菌MOI范围,选取6种配伍方式对6株噬菌体进行混合,测定6种配伍下多联噬菌体对混合金葡菌的抑菌效果,与抗生素进行比较,结果显示混合菌对超过7种(87%)的抗生素具有耐药性,而6种配伍的混合噬菌体均能以较小的MOI抑制混合菌液进入对数生长期,表明在对抗这些金葡菌引起的皮炎时,6种配伍的多联噬菌体较抗生素更适用。6种多联噬菌体对葡萄球菌生长无明显抑菌效果,表明多联噬菌体具有专一裂解金葡菌的特性。而各种稳定剂对多联噬菌体的稳定性测试结果显示,在4℃下以SM buffer、0.4 M D-海藻糖、0.4 M 蔗糖和10%甘油方式储存噬菌体比用0.8 M D-海藻糖、0.8 M 蔗糖和15%甘油进行储存更稳定。
参考文献(略)
