本文是一篇药学论文,本论文通过QTY code成功设计获得了水溶性重组人发角蛋白,但仅选择2种Ⅰ型(RK31、RK33A)和2种Ⅱ型(RK81、RK83)角蛋白进行改造设计,并未进行其余型号以及其他种类的角蛋白改造研究。因此,后续可将QTY code技术应用于其余型号和种类的重组角蛋白,探究水溶化改造对其生物性能的影响,进一步验证QTY code的可行性和适用性。
1 绪论
1.1 课题研究背景
1.1.1 角蛋白的概述
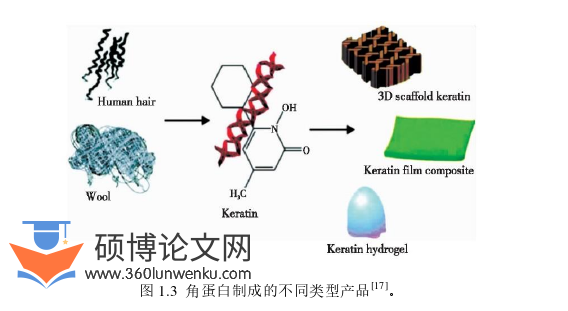
角蛋白是一种广泛存在于动物毛发、羽毛、表皮、指甲、角和蹄中的结构蛋白,是潜在的优质蛋白质来源之一[1, 2]。研究表明,角蛋白自身易降解,具有良好的生物相容性、较高的机械强度和可进行自组装等优点,且因其可以促进成纤维细胞黏附增殖进而促进细胞迁移和分化等特点而得到广泛应用[3, 4],国内外现已开展了大量关于角蛋白生物材料的相关研究。
角蛋白呈纤维状,具有长多肽链和交联纤维[5],其中,多肽链构成了其基本大分子结构,这些多肽链卷曲成螺旋形成α-构象或并排键合成褶皱片形成β-构象。因此,在结构上角蛋白可分为α-角蛋白和β-角蛋白,前者存在于哺乳动物中,是羊毛、毛发、爪子、蹄子、角和角质层的主要成分;后者主要存在于鸟类和爬行动物的坚硬组织中,如鸟类的羽毛、喙和爪子,以及爬行动物的鳞片和爪子[6]。角蛋白还可根据分布差异和氨基酸组成进行分类,存在于头发、羽毛和指甲等的角蛋白属于硬角蛋白,含有约5%的半胱氨酸;而存在于皮肤中的角蛋白属于软胶蛋白,含约1%的半胱氨酸[7]。人发角蛋白属于是高度交联的蛋白质,其中α-螺旋(α-helix)是最常见、最典型、含量最丰富的二级结构[8, 9]。经过前期的基因组研究分析表明,人发角蛋白有17种,主要分为Type I和Type II两类,I型角蛋白的分子量相对较低,包括KRT31、KRT32、KRT33A、KRT33B、KRT34、KRT35、KRT36、KRT37、KRT38、KRT39、KRT40;II型角蛋白的分子量相对较高,包括KRT81、KRT82、KRT83、KRT84、KRT85和KRT86[9, 10]。角蛋白是与中间丝(IFs)相关的富含半胱氨酸的蛋白质,是通过由30多种生长因子和细胞因子控制的高度增殖过程在毛囊中自组装成纤维[11]。角蛋白序列中有大量的半胱氨酸、甘氨酸、脯氨酸等,赖氨酸和蛋氨酸等含量较低,几乎不含有色氨酸[12, 13]。因此,与大多数蛋白质相比,其结构存在大量二硫键可发生分子间和分子内键合(如图1.1),从而具有更高的稳定性和更低的溶解度,这也是是由不同肽链的氢键、盐键、二硫键等作用力共同决定的[14-16]。角蛋白结构坚固、高度稳定,不溶于水和大多数有机溶剂,它们还对蛋白水解酶的酶促降解具有抗性,且具有很高的耐热性[12],这使得角蛋白的利用率和经济效益一直以来受到了一定限制[17]。因此,角蛋白可溶化是其在生物医学、环保、纺织等领域得到广泛应用的关键。
..................................
1.2 科学问题的提出及研究意义
药学论文参考
人发角蛋白作为天然的生物材料,因其在体内外易降解、具有良好的生物相容性,能够与细胞进行良好的相互作用,已在生物医学等领域得到了广泛应用[46]。角蛋白的水溶化处理是其在生物医学、环保、纺织等领域得到广泛应用的关键,传统使用的化学、物理或酶解等方法通常是将天然角蛋白分子间和分子内的二硫键适度断裂,获得的可溶性提取物往往结构和组分不可控;重组人发角蛋白具有组分单一、纯度高的优势,但其仍难溶于水和绝大部分有机溶剂。因此,如何通过蛋白质设计方法获得结构可控的水溶性重组人发角蛋白是本论文要解决的关键问题。
本论文使用QTY code对重组人发角蛋白的α-螺旋结构进行定向改造,获得了水溶性优、纯度高的重组人发角蛋白,通过结构近似的亲疏水氨基酸替换实现了重组角蛋白水溶性的提高,同时保持了原有的二级结构,进而研究了其水溶性提高对自组装、创面修复和止血性能的影响,为组织修复和止血等临床治疗提供了新策略并奠定了实验基础,对新型角蛋白生物材料的设计和开发具有理论和实践意义。
.........................
2 水溶性重组人发角蛋白的设计、表达纯化及理化表征
2.1 引言
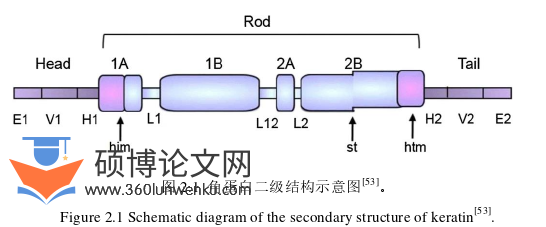
角蛋白属于中间丝(IF)蛋白,常以分化依赖性、组织特异性[47]和配对方式表达[48]。它们的特点是具有独特的物理化学性质,例如抗酶消化,不溶于稀酸、碱、水和有机溶剂[49, 50]。然而,这些蛋白质可溶于含有尿素等变性剂或十二烷基硫酸钠等去污剂的溶液中[51]。角蛋白属于多基因蛋白质家族,第一个角蛋白命名法由Moll等人作为综合角蛋白目录发表[51]。该目录包括19个成员,进一步分为I型和II型角蛋白。其中,I型IF蛋白是酸性的(pI 4.5-5.5),具有低分子量(40-56.6 kDa);Ⅱ型IF蛋白是碱性到中性(pI 5.5-7.8)并且具有更高的分子量(53-68 kDa),17种人发角蛋白也包括在此。角蛋白结构以氨基酸链为特征,并且可能在氨基酸的数量和序列以及极性、电荷和大小方面有所不同[52],然而,特定角蛋白的氨基酸序列在不同物种中非常相似[52]。所有IF蛋白都遵循一个共同的结构原则,包括一个大小保守的中心α-螺旋“棒”,其两侧是非α-螺旋N端“头”和C端“尾”末端结构域,且其大小和化学特征可变(如图2.1)[53, 54]。
药学论文怎么写
..............................
2.3 实验方法
2.3.1 主要试剂的配制
①LB固体培养基:称取Nacl 1.0 g,胰蛋白胨1.0 g,酵母提取物0.5 g,琼脂1.5 g,加ddH2O定量至100 mL,121℃高压灭菌25 min后备用。
②LB液体培养基:称取Nacl 1.0 g,胰蛋白胨1.0 g,酵母提取物0.5 g,加ddH2O定量至100 mL,121℃高压灭菌25 min后备用。
③50 mg/mL硫酸卡那霉素:称取1.0 g硫酸卡那霉素固体粉末,在超净工作台中用灭菌后用ddH2O溶解,并定量至20 mL,用0.22 μm滤膜过滤,分装于灭菌好的EP管中,置于-80℃保存备用。
④100 mg/mL氨苄青霉素:称取2.0 g氨苄西林固体粉末,在超净工作台中用灭菌后加入ddH2O溶解并定量至20 mL,0.22 μm滤膜过滤后分装于灭菌好的EP管中,-80℃保存备用。
⑤1M IPTG:称取4.766 g IPTG,用灭菌后ddH2O充分溶解并定量至20 mL,0.22 μm滤膜过滤后分装于灭菌好的EP管中,-80℃保存备用。 ⑥50 %甘油:20 mL甘油加入灭菌后ddH2O定量至40 mL,4℃保存。 ⑦裂解液Buffer A:8.766 g NaCl,6.057 g Tris,1.461 g EDTA,1.4 mL β-巯基乙醇,加ddH2O定量至1 L,pH调至8.0,4℃保存。
⑧洗涤液Buffer B:8.766 g NaCl,6.057 g Tris,1.461 g EDTA,1.4 mL β-巯基乙醇,60.06 g Urea,5 mL TritonX-100,加ddH2O定量至1 L,pH调至8.0,4℃保存。
⑨洗涤液Buffer C:29.22 g NaCl,6.057 g Tris,1.461 g EDTA,1.4 mL β-巯基乙醇,加ddH2O定量至1 L,pH调至8.0,4℃保存。
⑩结合液Buffer D:8.766 g NaCl,6.057 g Tris,480.48 g Urea,1.4 mL β-巯基乙醇,加ddH2O定量至1 L,pH调至8.0,4℃保存。
⑪洗杂液Buffer E:4.383 g NaCl,3.028 g Tris,240.24 g Urea,0.7 mL β-巯基乙醇,0.170 g 咪唑,加ddH2O定量至500 mL,pH调至8.0,4℃保存。 ⑫洗脱液Buffer F:4.383 g NaCl,3.028 g Tris,240 g Urea,0.7 mL β-巯基乙醇,8.510 g 咪唑,加ddH2O定量至500 mL,pH调至8.0,4℃保存。
⑬PBS溶液:22.4 g PBS缓冲液干粉加ddH2O定量至2 L,高温灭菌,4℃保存。
⑭洗杂液Buffer G:0.170 g 咪唑加入PBS溶液定量至500 mL,4℃保存。 ⑮洗脱液Buffer H:8.510 g 咪唑加入PBS溶液定量至500 mL,4℃保存。
⑯1×电泳缓冲液:称取3.02 g Tris,18.8 g甘氨酸,1.0 g SDS,加入ddH2O溶解并定量至1L,室温保存。
⑰染色液:称取考马斯亮蓝R-250 1.0 g,冰乙酸100 mL,异丙醇250 mL,加灭菌ddH2O定量至1 L。
⑱脱色液:冰乙酸100 mL,无水乙醇50 mL,灭菌ddH2O 850 mL,室温密封保存备用。
......................
3 水溶性重组人发角蛋白的生物活性评价 ............................ 29
3.1 引言 ...................................... 29
3.2 材料与仪器 ..................................... 31
4 水溶性重组人发角蛋白的生物相容性研究 .................................. 51
4.1 引言 ............................................. 51
4.2 材料与仪器 ............................................... 51
5 全文总结与后续工作建议 .................... 59
5.1 全文主要结论 ............................................. 59
5.2 后续工作建议 ................................... 61
4 水溶性重组人发角蛋白的生物相容性评价
4.1 引言
生物材料的安全性是由材料本身所具备的良好的生物相容性确保的[87, 88]。随着生物材料科学的不断发展,其体内外生物相容性评价已越来越受重视。通常,生物相容性包括材料和生物体的相互作用与反应,保持相对稳定、不被破坏和不发生排斥等[89, 90]。生物材料和组织两者相互可接受的长期共存方式的发展多年来一直是生物材料科学关注的焦点,并构成了生物相容性学科的基础,然而有很多方面可能会造成材料和组织接触时这种共存的破坏[91]。因此,能够提供良好性能的同时又能保持良好的生物相容性对生物材料至关重要。因此,生物相容性评价对生物材料应用至关重要。
评估生物相容性的目的是确定其毒性影响,以及对宿主造成损害或不良副作用的生物反应,应主要考虑炎症、伤口愈合和免疫反应/免疫毒性[92]。若某种生物医用材料具有良好的生物可降解性、无毒无致畸形、免疫原性低、可塑性和一定的机械强度等特点,则其易被吸收和降解,不会引起机体产生炎症反应,这种材料生物也被认为是相容性良好的理想材料[93-95]。评价生物材料的生物相容性方法很多,其中,最主要的方法是动物体内植入实验[96]。除此之外,在伤口修复过程中,细菌感染是不可避免的,严重时甚至会导致许多并发症,包括败血症。因此,有必要在植入材料时对动物进行急性毒性观察以及炎症因子等方面的检测。并且,生物材料在组织修复和止血过程中涉及刺激和调控相关细胞,以促进新组织再生和止血。
药学论文怎么写
..............................
5 全文总结与后续工作建议
5.1 全文主要结论
本论文通过QTY code设计了4种重组人发角蛋白RK31、RK33A、RK81、RK83的水溶性变体RK31QTY、RK33AQTY、RK81QTY和RK83QTY,成功构建其质粒,利用重组蛋白异源表达技术获得了水溶性重组人发角蛋白粉末并进行了相关理化性质表征。然后基于角蛋白中间丝在体外能自组装的特性,探究了水溶性重组人发角蛋白的自组装性能,利用其良好的溶解性和自组装能力实现了原位成凝胶,通过构建相关动物模型评价了其创面修复和止血性能。本论文的相关研究工作主要结论如下:
首先,从NCBI中获得RK31、RK33A、RK81、RK83的氨基酸序列,利用QTY code设计对应的水溶性变体RK31QTY、RK33AQTY、RK81QTY、RK83QTY,通过构建质粒利用大肠杆菌原核系统表达以及Ni-His亲和纯化获得了水溶性重组人发角蛋白粉末,并对其进行了理化表征。基因测序及在线预测表明水溶性重组人发角蛋白均构建成功,与重组人发角蛋白相比,QTY code改造前后蛋白二级结构成分类似,均主要为α-螺旋。通过凝胶电泳结果显示,水溶性重组人发角蛋白多以二聚体及更高聚体形式存在,MS/MS检测蛋白质覆盖率结果为90%,验证了获得的重组蛋白为目的蛋白。接触角测量结果显示,QTY code改造后水溶性重组人发角蛋白RK31QTY、RK33AQTY、RK81QTY、RK83QTY的接触角分别为39.56°、47.31°、41.35°、42.23°,显著低于重组人发角蛋白RK31、RK33A、RK81、RK83的接触角73.73°、73.03°、70.60°、71.24°,且与人发提取角蛋白的接触角的40.47°相似,QTY code改造使角蛋白的亲水性显著减小。通过对其水溶性进行分析,难溶性重组人发角蛋白水溶性低于50 μg/mL,而水溶性重组人发角蛋白水溶性约为10 mg/mL,通过QTY code改造使原重组角蛋白的水溶性至少提高了200倍。此外,对水溶性重组人发角蛋白结构进行分析,CD图谱显示,其二级结构与改造前重组角蛋白和人发提取角蛋白类似,主要为α-螺旋,这也与预测结构相符。FT-IR图谱显示,水溶性重组人发角蛋白具备了蛋白质的红外特征吸收峰,与原重组人发角蛋白、人发提取角蛋白的特征峰表现一致。
参考文献(略)
