第一章 绪论
1.1 SHP2与肿瘤
1.1.1 蛋白酪氨酸磷酸酶
蛋白酪氨酸激酶(protein tyrosine kinase,PTK)与蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)共同调节蛋白酪氨酸磷酸化。这是一种动态且可逆的翻译后修饰,涉及细胞增殖、分化、迁移等活动 [1] 。酪氨酸磷酸化活性的增加是许多癌症的标志,通常是由于受体 PTK(如 EGFR)和非受体 PTK(如 Abl 和 Src)的过度激活和表达引起的[2]。
PTP 大体分为受体样形式和非受体形式[3]:受体样 PTP 有一个单一的跨膜结构域和可变的胞外结构域;非受体 PTP 结构具有多样性,通常包含靶向到特定亚细胞位置或使其与特定蛋白质结合的序列[4]。PTP 构成了一个庞大的、结构多样的酶家族,参与调控细胞的生命活动。由于这些酶在信号转导中的重要作用,它们的异常调节常常与各种人类疾病的发病机制相关,包括糖尿病、癌症和自身免疫疾病[5,6]。PTP 主要对磷酸酪氨酸(pTyr)残基进行去磷酸化,通常被认为是信号通路的负调控因子和肿瘤抑制基因的产物[7,8]。但是尽管许多 PTP 具有抑制肿瘤的作用,在对人类癌症的遗传信息进行分析发现,一些 PTP 具有致癌活性[9]。可能原因是部分 PTP 除了对受体酪氨酸激酶(RTK)信号转导有负调控作用外,还对 RTK 信号转导有正调控作用[10]。
1.1.2 SHP2 结构与功能
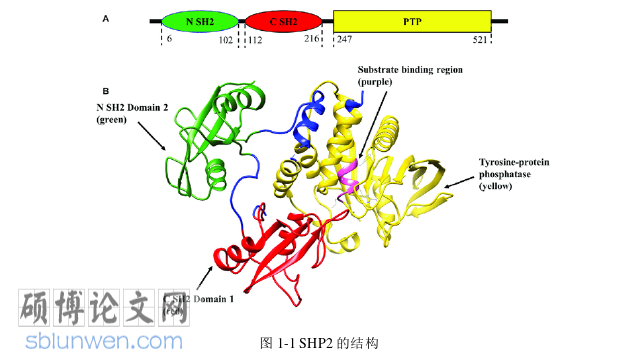
胞内蛋白酪氨酸磷酸酶 SHP2(SH2 domain-containing protein-tyrosine phosphatase-2)是非受体型酪氨酸磷酸酶。SHP2 全长 593 个氨基酸,结构上,SHP2 具有四个结构域。包括 N 端的两个特有的 SH2 结构域(N-SH2 和 C-SH2)和位于中间的酪氨酸磷酸酶家族所共有的 PTP 催化域及 C 末端具有重要磷酸化修饰位点的尾部结构域 (图 1-1A)。如图 1-1B 所示,在没有上游信号刺激的情况下,N 端的 N-SH2 会以类似底物的形式深入到 PTP 催化域的催化口袋中,并通过盐桥、氢键等作用力使其维持在自抑制状态,C-SH2结构域在这里只起到连接 N-SH2 和 PTP 催化域的作用。当细胞因子刺激时,自抑制结构解除,PTP 催化结构域的活性位点暴露出来,从而对下游信号分子进行去磷酸化,激活参与细胞增殖、迁移和其它相关的下游信号通路(图 1-2)[11]。
药学论文怎么写
1.2 PROTAC技术与应用
1.2.1 PROTAC 技术简介
小分子抑制剂已用于治疗癌症多年,但同时小分子抑制剂也存在一些局限性。首先,抑制剂通过与蛋白质的一个结构域结合起作用,而蛋白质通常是由多个结构域组成的,因此其非结合结构域的功能不受影响,例如支架功能;其次,具有结合口袋的蛋白质只占整个蛋白质组的一小部分,有许多不可用药的蛋白质不能被抑制剂处理;除此之外,抑制剂需要高饱和药物浓度才能起作用,而副作用也总是随之而来;还有些抑制剂与多个靶标结合,会导致脱靶;另外,经过抑制剂治疗的癌细胞可以通过突变或其他机制对抑制剂产生耐药性[39]。因此为了解决这些问题,人们致力于设计创新的治疗方法。在这些新方法中,蛋白降解靶向嵌合体(proteolytic targeting chimera,PROTAC)技术近年来很受欢迎。
PROTAC 技术是目前开发治疗人类疾病的一种新方法。自问世以来,因其独特的优势得到越来越多人的认可。该项技术的核心是将小分子设计成为一种新型药物,通过将蛋白送入蛋白酶体并使其降解,是一种利用泛素蛋白酶系统针对特定蛋白并诱导其在细胞内降解的策略[40]。泛素-蛋白酶体系统是人体内负责调控蛋白质降解过程的途径之一 [41]。包括泛素、3 种泛素化酶、蛋白酶体及其底物蛋白。第一步,E1 泛素激活酶消耗ATP,产生活化的泛素-腺苷酸进而转化为硫酯中间体。随后进行转硫醇化反应,泛素从E1 酶转移至 E2 泛素结合酶。最后,泛素通过桥接 E3 泛素连接酶的作用转移到底物蛋白上[42]。该循环可以重复产生多聚泛素链,进而引导底物在蛋白酶体处降解[43]。
作为异双功能分子,PROTAC 化合物由结合目标蛋白的配体、Linker 和 E3 泛素连接酶配体组成[44]。进入细胞后,PROTAC 结构中的靶蛋白配体可特异性地与靶蛋白结合,另一端的 E3 连接酶配体与 E3 连接酶结合,形成三元复合物(图 1-7),E3 连接酶介导泛素结合酶 E2 将靶蛋白泛素化。之后三元复合物解离,被泛素标记的靶蛋白会被输送到蛋白酶体中降解,从而选择性地降低靶蛋白的水平 [45]。
.............................
第二章 SHP2降解剂目标化合物的确立
2.2 实验方法
2.2.1 分子酶活测试方法
通过前期实验室建立的分子水平 SHP2 酶活性检测体系检测阳性化合物的 IC50,以此来确认蛋白的活性及体系的稳定性,之后对系列化合物进行分子水平上酶活检测。 具体实验操作如下:
(1) 检测体系溶液配制:HEPES buffer(60 mM HEPES, pH 7.2, 75 mM NaCl, 75 mM KCl, 1 mM EDTA, 0.05% Tween-20, 5 mM DTT);
(2) 样品预处理:将化合物以 10 mM 的浓度溶解在 DMSO 中并于 -80 ºC 保存。实验时在 96 孔化合物稀释板中将化合物母液以最高终浓度为 20 µM 开始三倍梯度往下稀释。多肽 2P-IRS-1(终浓度为 2 µM)通过在 25 ºC 条件下与 WT-SHP2 全长蛋白(终浓度为 0.4 nM)共孵育 60 min 来激活蛋白;
(3) 在 384 孔黑色微孔板中检测酶活性:将小分子与 20 µL 酶在孔板中共孵育20 min 后离心混匀,再后加入荧光底物 DiFMUP(终浓度 25 µM)起始反应。反应体系终体积为 50 µL,离心混匀后使用酶标仪检测激发/发射波长 340/450 nM 通道计算反应初速度;
(4) 数据处理: 通过样品活性对样品浓度进行非线性拟和而得到 IC50值,计算所用软件为 Graphpad Prism 8,拟合所使用的模型为四参数剂量效应积分模型(four-parameter concentration-response model)(varible slope)。
2.2.2 细胞培养方法
本课题实验所用细胞均按照 ATCC 官网中培养方法进行培养。MV-4-11 使用的培养基为添加了 10% 的血清的 IMDM,通常我们也会在培养基中加入 100 mg/L 的青霉素与链霉素。操作完细胞后将其置于 CO2细胞培养箱(5% CO2,95% 空气,37 ℃)中进行培养。由于 MV-4-11 为悬浮细胞,可直接离心后按照 1:3 的比例进行传代。离心的转速均为 800 rpm,共 3 min。
...............................
2.3 实验结果
2.3.1 化合物分子水平初筛结果
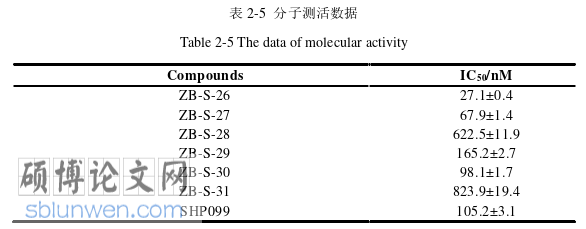
合作者根据不同的 E3 共设计合成六个小分子降解剂,其中 ZB-S-26 与 ZB-S-29 的E3 为 CRBN;ZB-S-27 与 ZB-S-30 的 E3 为 VHL;而 ZB-S-28 与 ZB-S-31 的 E3 为 MDM2。我们选择阳性化合物 SHP099,验证蛋白活性和系统稳定性之后,进行这 6 个化合物在分子水平上对 SHP2 蛋白酶活抑制的测试。实验结果如下表 2-5 所示。由分子酶活测试结果可知,六个化合物对 SHP2 蛋白均有抑制效果,其中 ZB-S-26、ZB-S-27、ZB-S-29及 ZB-S-30 对 SHP2 蛋白的酶活抑制效果较好,而 ZB-S-28 与 ZB-S-31 的效果相对弱一些。
药学论文怎么写
第三章 SHP2 降解剂生物活性及作用机制研究............................... 20
3.1 实验材料 ........................................ 20
3.1.1 细胞来源 ............................................. 20
3.1.2 试剂耗材来源 ...................................... 20
第四章 SHP2 降解剂新适应症的探寻................................. 31
4.1 实验材料 ...................................... 31
4.1.1 细胞来源 ............................ 31
4.2 实验方法 ............................... 31
第五章 探寻新母核结构的 SHP2 降解剂........................ 36
5.1 实验材料 .................................. 36
5.1.1 实验试剂 ......................................... 36
5.1.2 实验耗材 ........................................ 36
第五章 探寻新母核结构的SHP2降解剂
5.1 实验材料
5.1.1 实验试剂
目前 SHP2 小分子调节剂多以 SHP099 为母核改造而来,包括我们的化合物 11。另外 SHP2 蛋白存在许多突变体,尤其是 SHP2-E76K 最为代表及突出。而我们之前筛选到的化合物 11 虽然对 SHP2-WT 有比较好的降解效果,对突变体却没有理想的作用。故为了拓宽 SHP2 小分子调节剂的母核结构范围,同时设计出更多靶向 SHP2-WT 以及SHP2-E76K 突变体的降解剂。合作者设计了 18 个具有非 SHP099 母核结构的化合物,通过分子酶活测试,筛选出 5 个有潜力的小分子,之后进行与 SHP2-WT 及 SHP2-E76K的结合实验,判断是否可以以此为基础进而设计出更多全新结构的可以降解 SHP2-WT或者 SHP2-E76K 的 PROTAC 小分子。
药学论文参考
主要结论与展望
主要结论
一、本课题合作者利用蛋白靶向降解技术合成了一系列 SHP2 降解剂,之后我们通过系统性生物学评价结合化合物的结构改造发现了对 MV-4-11 细胞株的 SHP2 蛋白具有较好降解效果的化合物 11:
1) 化合物 11 在 MV-4-11 细胞上可以呈时间梯度及浓度梯度地降解 SHP2 蛋白,且在 MV-4-11 细胞上降解 SHP2 蛋白的 DC50为 6.02 nM;
2) 化合物 11 抑制 MV-4-11 细胞增殖的效果要优于阳性化合物 SHP099;
3) 化合物 11 可以引起 MV-4-11 细胞 G1/S 期周期阻滞及细胞凋亡,且化合物 11 的效果要优于 SHP099;
4) 通过 CRBN 调节剂来那度胺与泊马度胺的占位竞争实验及蛋白酶体抑制实验证明化合物 11 降解 MV-4-11 细胞中的 SHP2 依赖 CRBN。之后利用实验室构建好的 CRBN敲除的 MV-4-11 细胞株与未敲除 CRBN 的 MV-4-11 细胞株进行对比,进一步证明化合物 11 发挥 SHP2 降解作用依赖 CRBN;
5) 不足之处在于最后进行细胞水平模拟动物水平药代实验及动物水平上的急性药效试验时,目前暂未看到较好的结果。
二、另外考虑到 SHP2 蛋白除了酶活作用外,还具有如支架功能等其它非酶活作用,因此我们希望利用化合物 11 来发现更多 SHP2 发挥非酶活作用的敏感细胞株,进而拓宽化合物的适应症。我们通过瘤谱筛选锁定了多发性骨髓瘤 MM1S 细胞株,初步的实验表明化合物11抑制了MM1S的细胞增殖,并可以呈时间梯度与浓度梯度地降解MM1S细胞中的 SHP2 蛋白。但是考虑到 MM1S 是度胺类化合物经典的敏感细胞株,而我们的化合物 11 含有泊马度胺的结构,后续也表明化合物 11 对 MM1S 细胞的增殖抑制可能来源于其对 IKZF1 与 SHP2 蛋白共同的降解,因此我们需要进行后续的验证。另外这也为之后有关多靶降解剂的设计合成提供了新的思路与方向。
参考文献(略)
