第一章 前言
1.1课题背景
骨髓增生异常综合征(MDS)是由造血干细胞异常增殖和分化引起的造血功能障碍。主要表现为外周血全血细胞减少,骨髓细胞增生,成熟和未成熟细胞形态异常,即病态造血。
到目前为止,临床上对症治疗(输注血液成分、造血生长因子、抗生素)仍然是目前治疗的主流。在过去几年中,FDA 批准了三种改变患者的治疗过程和预后的药物,分别为:免疫调节因子雷利度胺(lenalidomide)、DNA甲基转移酶抑制剂阿扎胞苷(azacitidine)和地西他滨(decitabine)。而阿扎胞苷的主要竞争对手是地西他滨(decitabine),但Gidwani等人通过实验验证了氮杂胞苷和地西他滨的成本效益。结果表明,与地西他滨相比,阿扎胞苷治疗可以使患者获得更高的生存率,更有可能摆脱输血依赖,更有效地防止疾病恶化为急性髓系白血病。因此,阿扎胞苷在 MDS 的治疗中具有更大的临床益处和更高的成本效益。
............................
1.2注射用阿扎胞苷的研究进展
阿扎胞苷,化学名为 1-(-D-呋喃核糖基)-4-氨基-1,3,5-三嗪-2(1H)-酮,又名 5-氮杂胞苷,氮杂胞苷,商品名维达莎®,分子式 C8H12N4O5。阿扎胞苷为白色针状晶体,无气味。在空气中稳定,熔点 226 ~ 232℃,比旋度 +6° ~ +10° (20mg/mL 二甲基亚砜溶液)。溶于二甲基亚砜,微溶于乙醇:水(50:50)、丙二醇、聚乙二醇;微溶于水,饱和辛醇水溶液,5% 葡萄糖注射液,N-甲基-2-吡咯烷酮,0.9% 氯化钠注射液,5% 聚山梨酯 80 水溶液;不溶于丙酮、乙醇和甲乙酮。
1964 年捷克斯洛伐克化学实验室通过把胞嘧啶嘧啶环的 5 位碳原子转化为氮原子合成了核酸合成抑制剂。这种核苷类似物被命名为阿扎胞苷,其具有杀死癌细胞的作用,因此已经被研究作为急性白血病和其他恶性肿瘤的治疗剂。自1971年以来,在美国国家癌症研究所(NCI)的支持下,已经进行了大约 80 项阿扎胞苷单独或联合临床试验。另一方面,自 19 世纪 80 年代以来,阿扎胞苷抑制DNA 甲基化并诱导细胞分化,并且由于提示癌症和 DNA 甲基化之间存在联系,因此它是骨髓增生异常综合症(MDS)的治疗药物。
从 2008 年 12 月阿扎胞苷在欧盟获得批准开始,一直到 2017 年期间,其在世界享有罕见疾病的医学地位。美国国家癌症网络将其列为治疗中度-2 和高危MDS 患者的一类推荐药物。英国国家卫生与临床研究认为其是一种创新的、延长生命的、具有成本效益的药物。日本新药株式会社在日本上市了用于治疗骨髓增生异常综合征(MDS)的阿扎胞苷。其在我国于 2017 年 4 月获得批准上市。商品名 Vidaza ®,进口注册证号 H20170238,公司 Celgene Europe Ltd.,阿扎胞苷为无菌冻干粉针剂,每瓶含阿扎胞苷和甘露醇各 100 mg。参照 FDA 的 BE指导原则《Draft Guidance on Azacitidine》本品作为皮下给药的混悬型注射液,受试品豁免生物等效性试验应提供理化性质、粒子形态和粒径与参比制剂体外一致的证据。故本品研发过程中,除了关注常规注射剂关键质量属性外,还需要对上述三方面的性质展开研究使其与参比制剂一致。
...............................
第二章 原料药相关属性研究报告
2.1 原料药研究所用仪器与材料
为了使处方工艺研究阶段顺利进行,本章对原料药的晶型、杂质、引湿性、粒度和原辅料相容性进行研究,给后续处方工艺的设计奠定了基础。

药学论文怎么写
2.2原料药研究方法与结果
2.2.1 原料药基本信息及其对制剂处方工艺开发的影响
在参比制剂的研究基础上,根据制剂剂型的特点,对原料药的基本性质进行文献调研,本品的基本性质及其对制剂处方工艺开发的影响如表 2.3。
2.2.2 原料药晶型研究
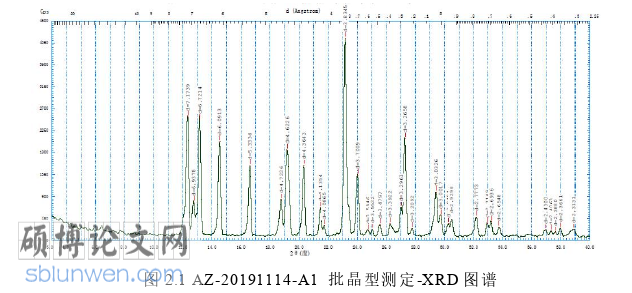
根据专利 US 20040186065A1 的报道,阿扎胞苷原料有 8 种晶型(I~VIII),见图 2.2~图 2.9,所有晶型在水溶液中最终均转化为晶型 III(完全转化需要一定的时间),采用 X 射线粉末衍射(XRD)法进行分析以确定原料药晶型及稳定性期间晶型是否产生变化。
取适当样品 API 进行粉末 X 射线衍射测量。测量条件为:CuKa 靶石墨单色仪衍射光束单色比,高压 50 KV,单电流 35 mA,扫描角度扫描 2θ 角度为4-80º,扫描步长 0.013º/步,每步时间 10-20S/步。结果如表 2.4 所示。
药学论文参考
第三章 注射用阿扎胞苷的处方工艺研究........................... 17
3.1 仪器与材料....................................... 17
3.2 工艺参数的开发..................................18
第四章 注射用阿扎胞苷的质量控制研究................. 41
4.1 仪器与材料...................................... 41
4.2 注射用阿扎胞苷有关物质方法建立与验证...................42
总结................................. 73
第四章 注射用阿扎胞苷的质量控制研究
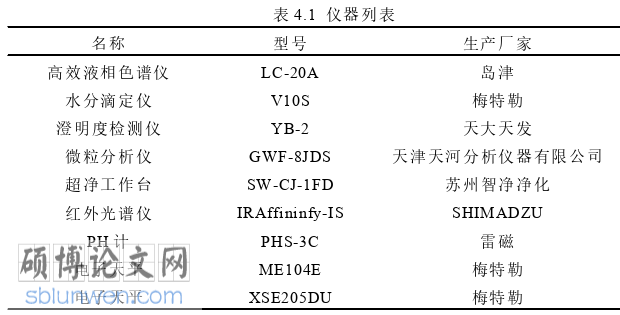
4.1仪器与材料
药学论文参考
.......................
总结
阿扎胞苷是一种胞嘧啶核苷类似物,主要用于治疗骨髓增生异常综合征。美国 FDA 于 2004 年批准该药物上市,由于该药物的活性成分阿扎胞苷稳定性较差,在水中迅速水解,所以市场上的制剂为粉针制剂。
阿扎胞苷在水溶液中会降解为一阶水解物 N-甲酰脒基核糖基脲,进一步降解为二阶水解物脒基核糖基脲及其异构体,本文的目的是阻止降解,减缓一阶水解产物和二阶水解产物的产生速率。配方中加入有机溶剂乙腈并筛选合适的溶剂比例以减低水解速率。
将药物活性成分预先微粉化至粒径 1-1.2 μm 以加快溶解速率。如果不通过加速溶解速率的方式,整个工艺生产过程,原料溶解总时间所产生的水解杂质将会超过 2.5%,超出成品放行的可接受标准,使生产几乎不可能进行。而通过本工艺,可在数小时以内保持水解杂质含量小于 2.5%。同时,通过控制粒径、冻干时预冻方式、降温速率等参数,大大的提高了成品的质量。并在生产过程采用低温配液的方法,缩短了工艺时间,提高本品的产量。本研究对阿扎胞苷生产工艺优化后,显著减缓了阿扎胞苷水解杂质的生成速度,使之能生产出杂质水平优于原研品的药品,减少了杂质谱中相关杂质的基因毒性隐患。在生产过程采用 2-8℃的低温配液提高了生产速度,显著缩短了原料溶解时间,提高药液稳定性,从而提高制剂质量和产量。
为解决现有技术中存在的问题,本文提供了一种注射用阿扎胞苷冻干粉针及其制备方法,可有效控制产品的粒径和总杂质水平,生产出生物等效性指标与原研品相当,满足生物等效性要求,总杂质水平优于原研品的产品。
参考文献(略)
