本文是一篇农业论文,本文以温度作为单因素变量,分别设置高温胁迫、低温胁迫和周期性变温三种模式,探究温度变化对中华绒螯蟹抗氧化系统、非特异性免疫系统、免疫相关基因表达、肠道微生物以及代谢组的影响。
1 前言
1.1 研究背景
中华绒螯蟹是我国重要的水产养殖对象,因其味道鲜美,营养丰富,具有较高经济价值,近年来其养殖业获得了持续发展,在2021年我国中华绒螯蟹养殖总产量已经达到775,887吨以上[1]。近年来中华绒螯蟹的养殖规模不断扩大,然而在其养殖生产过程中,该水产动物经常遭遇病害、蜕壳未遂、成活率低、早熟等因素的制约[2]。温度、盐度、pH、溶氧、光照等诸多环境因子都会对中华绒螯蟹的生长发育产生影响,其中温度对中华绒螯蟹的抗病、摄食、蜕壳、成熟、繁殖的影响尤为重要。适宜的温度条件是任何生物生存的重要保证。
在外界的饲养条件下,水温很难把控。当前中华绒螯蟹饲养模式均需要在池塘、苇塘或者稻田等外界条件下进行,水温经常会受到自然天气和气候的影响,极端的天气或气候会给中华绒螯蟹的生长发育带来极大的挑战。由于鱼类和甲壳类生物属于变温动物,因此,一旦环境温度波动较大,超过水生生物自身所能承受的温度阈值,这种波动就可能会对其产生直接的负面影响[3]。在一定限度内,随着水温的升高,中华绒螯蟹的摄食量会随之增加,生长发育也会随之加快,但是温度过高会造成机体损伤,且高温条件下,中华绒螯蟹病害发生概率会大幅增加。反之,随着水温降低,中华绒螯蟹的摄食量会随之减少,导致摄入营养物质不足,从而造成生长缓慢,如果水温过低,中华绒螯蟹将停止摄食,严重威胁其生存。因此,温度高于或者低于最适温度都会给中华绒螯蟹生长发育带来负面影响。之前的研究表明,中华绒螯蟹可以在水温19~25℃条件下正常蜕壳生长,在水温20~26℃条件下摄食最旺盛,28℃可能是发生病害时的温度,如果水温高于30℃或低于10℃,中华绒螯蟹将停止生长和蜕壳[4–6]。虽然之前已经有诸多关于温度对中华绒螯蟹生长发育影响的相关报道,但是关于中华绒螯蟹生长发育温度上下限,最适温度的精准测定,以及过高温度和过低温度对中华绒螯蟹产生的负面影响机制还缺乏深入研究。
农业论文怎么写
............................
1.2 温度对水产动物生长、发育和存活的影响
温度是影响水生生物最重要的环境因子之一,它既能直接影响水体中溶解氧浓度、盐度、碱度以及氨氮等重要离子含量的变化,还可以直接或者间接的影响生物的生长、发育和存活。水产动物包括鱼类和甲壳类等均属于变温动物,当水体温度介于水产生物耐受阈值范围内,则可以存活,且不同的物种有其特有的最适生长发育温度。水温高于或低于其最适温度均会影响水产动物的摄食量、消化率以及饵料同化为机体组织的效率,进而影响生长性能[11]。目前,关于温度影响鱼类生长发育和存活的报道较多,如驼背鲈(Cromileptes altivelis)幼鱼在水温为28℃时生长速度最快,存活率最近佳,而高温32℃则对其生长有抑制作用[12];四川华鳊(Sinibrama taeniatus)仔稚鱼生长发育的最适温度为25~28℃,25℃条件下成活率最高[13];温度影响施氏鲟(Acipenserschrenckii)幼鱼生长的研究表明,其特定生长率和相对增重率在15℃~24℃范围内随着养殖温度的升高而显著增大,均在24℃时达到最高值[14];美洲黑石斑(Centropristis striata)幼鱼的最适生长温度为22~26℃,在18~30℃内,随温度的升高其饲料系数、最终体重、特定增长率均出现先升高后降低的趋势,在成活率方面,30℃的成活率最低,为88.2%[15]。
对于甲壳类动物而言,温度更是重要的环境因子,由于甲壳类生物独特的蜕壳生长发育机制,致使其在整个生命周期中对温度环境因子高度敏感。在一定温度范围内,甲壳类水产动物生长发育速度随着温度的升高而加快。有研究表明,脊尾白虾(Exopalaemon carinicauda)幼体体长增长率和变态存活率在16~32℃范围内,随着温度的升高而增加[16];青虾(Macrobrachium nipponense)[17]、克氏原螯虾(Procambarus clarkii)[18]、日本囊对虾(Penaeus japonicus)[19]和中华原钩虾(Eogammarus sinensis)[20]也会出现此现象。除此之外,另有报道表明,温度是影响钩虾(Gammams locusta)最显著的环境因子,在一定温度条件范围内,适当提高温度可以缩短钩虾的时代时间,提高个体增长率,提早性成熟和增加种群密度[21]。
............................
2 材料与方法
2.1 高温胁迫对中华绒螯蟹生理生化、抗氧化、免疫、肠道微生物及代谢组的影响
2.1.1 实验用蟹及饲养条件
本实验于2021年10月至12月在中国水产科学研究院黑龙江水产研究所进行。在当地养殖场挑选体质健壮、活力较强、附肢完整的中华绒螯蟹幼蟹(8.6±1.5g)用于实验。实验开始前,将挑选好的幼蟹暂养于充分曝气自来水的循环过滤玻璃缸中,驯化2周。暂养期间水温维持在24±0.1℃。pH为7.0至8.0之间,溶解氧为6.5±0.5 mg/L,每天换水量约为总量的1/3,且每天定时定量投喂。
2.1.2 实验方法
实验开始前停饲24小时。实验分别设置对照组(CG)和高温胁迫组(HG),每组设置四个平行,每个平行随机挑选100只规格整齐的幼蟹进行试验。利用水族箱加热器和制冷机,保持水温在所需的温度。对照组保持与驯化期间温度一致,始终维持原系统水温24℃直至试验结束;而高温应激组,则从驯化水温24℃的系统转移到水温32℃的系统中,试验期间始终维持高温胁迫组系统水温32℃。所有循环水系统的水温均由ZNCX-30型智能程控温控箱与制冷机和加热棒相连共同实现,各实验组循环水均由气石不断充气,且不提供任何食物。
2.1.3 样品采集与保存
试验期间,分别于0 h、6 h、12 h、24 h、48 h、72 h、96 h、7 d时间点进行采样。每组平行中在每个时间点随机抽取10只蟹,采集完整的河蟹肝胰腺用液氮冷冻后保存于−80℃冰箱中,留待进行生化分析;用不含抗凝剂的1.0 mL注射器从每只蟹的腿部关节第三步足基部处抽取血淋巴,然后将血淋巴放置于4℃冰箱中,静置12 h后用注射器针头搅碎,在高速冷冻离心机中离心10 min(8000 r/min),取上清液保存于−80℃冰箱中,留待进行生化分析。
在第7 d时,从每个组平行抽取10只蟹肠道,混样后分别装于无菌的冻存管中,用液氮冷冻后保存于−80℃冰箱中,留待进行肠道微生物多样性分析;采集完整的河蟹肝胰腺用液氮冷冻后保存于−80℃冰箱中,留待进行代谢组分析。
...........................
2.2 低温胁迫对中华绒螯蟹生理生化、抗氧化、免疫、肠道微生物及代谢组的影响
2.2.1 实验用蟹及饲养条件 同2.1.1。
2.2.2 实验方法
实验开始前停饲24小时。实验分别设置对照组(CG)和低温胁迫组(Cold),每组设置四个平行,每个平行随机挑选100只规格整齐的蟹进行试验。利用水族箱加热器和制冷机,保持水温在所需的温度。对照组保持与驯化期间温度一致,始终维持原系统水温24℃直至试验结束;而低温胁迫组,则从驯化水温24℃的系统转移到水温12℃的系统中,试验期间始终维持低温胁迫组系统水温12℃。所有循环水系统的水温均由ZNCX-30型智能程控温控箱与制冷机和加热棒相连共同实现,各实验组循环水均由气石不断充气,且不提供任何食物。
本实验于2022年3月至5月在中国水产科学研究院黑龙江水产研究所进行。在当地养殖场挑选体质健壮、活力较强、附肢完整的中华绒螯蟹幼蟹(7.5±0.8 g)用于实验。实验开始前,将挑选好的幼蟹暂养于充分曝气自来水的循环过滤玻璃缸中,驯化2周。暂养期间水温维持在24±0.1℃。pH为7.0至8.0之间,溶解氧为6.5±0.5 mg/L,每天换水量约为总量的1/3,且每天定时定量投喂。
................................
3 结果与分析................................ 16
3.1 高温胁迫对中华绒螯蟹生理生化、抗氧化、免疫、肠道微生物及代谢组的影响 ...................... 16
3.1.1 生理生化指标 .................... 16
3.1.2 抗氧化酶 ......................... 17
4 讨论 ......................................... 57
4.1 高温胁迫对中华绒螯蟹生理生化、抗氧化、免疫、肠道微生物及代谢组的影响 ..................................... 57
4.1.1 高温胁迫对中华绒螯蟹生理生化、抗氧化及免疫的影响 .. 57
4.1.2 高温胁迫对中华绒螯蟹相关基因表达量的影响 .................. 58
5 结论 .......................... 71
4 讨论
4.1 高温胁迫对中华绒螯蟹生理生化、抗氧化、免疫、肠道微生物及代谢组的影响
4.1.1 高温胁迫对中华绒螯蟹生理生化、抗氧化及免疫的影响
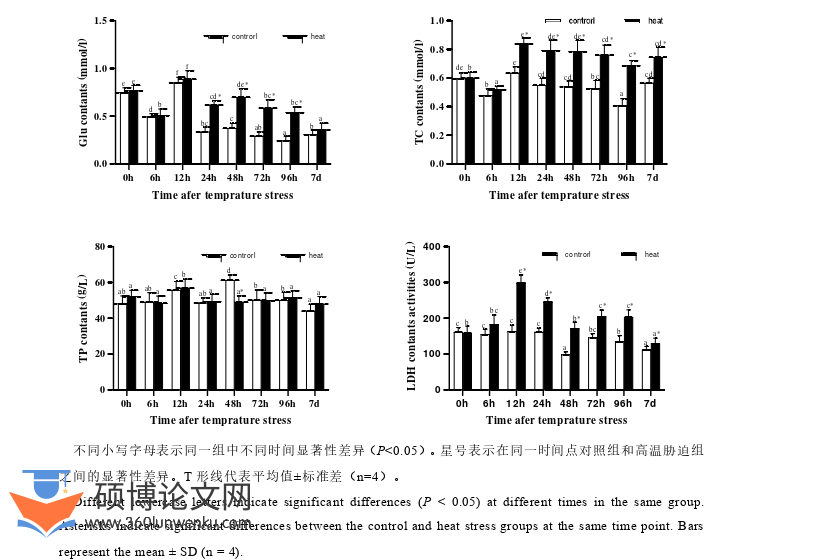
对于甲壳类动物来说,肝胰腺不仅是重要的消化、代谢器官,而且还能行使类似于脊椎动物典型肝脏的功能进行毒素降解与机体免疫[70–73],因此,肝胰腺是否处于健康状态对于中华绒螯蟹的生存和生长来说至关重要。本实验测定了中华绒螯蟹肝胰腺组织中AKP、ACP的活性,肝胰腺中的AKP和ACP是参与构成甲壳类非特异性免疫系统的第一道屏障[41,42]。本实验结果显示,中华绒螯蟹肝胰腺的AKP和ACP活性在高温胁迫后的短期内均显著升高,后期显著下降,这一结果与小龙虾高温胁迫研究[74]是一致的。AKP和ACP活性的变化表明,高温胁迫可能破坏了中华绒螯蟹的非特异性免疫屏障。不仅如此,ACP和AKP活性的异常也预示着肝胰腺组织发生了病理性损伤而诱发功能障碍[75]。由于AKP还是磷酸盐和膜转移的水解酶,任意组织的细胞膜发生损伤后都会引起AKP水平的波动[76],因此,高温胁迫可能损害肝胰腺组织细胞,增加细胞膜通透性。除此之外,AST和ALT也被用作肝功能是否健康的生理指标,通过测定AST和ALT的活性可以初步评估肝胰腺的损伤程度和功能障碍情况[45],当肝胰腺遭受实质性损伤和细胞膜通透性增加时,AST和ALT水平将显著升高[46]。从本实验结果来看,高温胁迫后AST和ALT的水平均升高,因此,高温胁迫可能造成了肝胰腺组织损伤和细胞膜通透性增加。这与小龙虾受高温胁迫后的研究结果一致[77]。综上所述,高温胁迫条件下,中华绒螯蟹产生了应激反应,其肝胰腺可能受到损伤。
在一定范围内,外界环境温度越高,变温动物自身消耗的能量就越多,高温会提高动物呼吸代谢速率,从而引发无氧代谢,以满足大量的能量需求[78]。LDH被认是动物无氧代谢能力的重要指标[79]。无氧代谢产生的乳酸可用作机体继续氧化供能的底物,而LDH可以催化乳酸和丙酮酸之间的可逆转化[79]。本实验结果显示,从高温胁迫的第12 h开始,一直到实验结束,血淋巴中LDH的水平显著增加,这与之前三疣梭子蟹对温度变化的能量响应实验研究[80]结果一致。出现这种现象的合理解释是,高温胁迫可能启动了中华绒螯蟹的无氧呼吸代谢机制,从而促进了LDH的合成以保证无氧呼吸代谢效率。此外,LDH是糖异生过程的关键酶[81],因此,为了进一步研究能量和物质代谢,我们还测定了血淋巴中的Glu含量。碳水化合物,包括葡萄糖,是参与有氧和无氧代谢的底物来源之一。
农业论文参考
............................
5 结论
本文以温度作为单因素变量,分别设置高温胁迫、低温胁迫和周期性变温三种模式,探究温度变化对中华绒螯蟹抗氧化系统、非特异性免疫系统、免疫相关基因表达、肠道微生物以及代谢组的影响,结论如下:
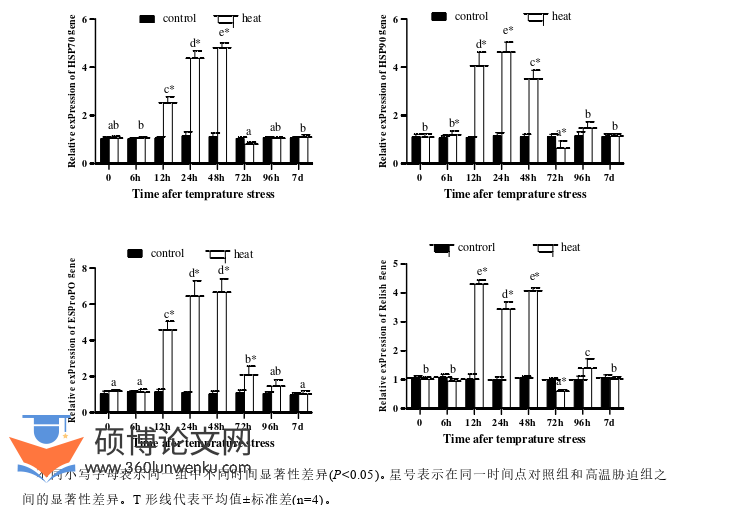
(1)中华绒螯蟹可通过调节LDH、CAT、SOD、MDA、T-AOC、AKP、ACP、AST、ALT等抗氧化和免疫酶活性,以及HSP 70、HSP 90、Relish、proPO等基因的表达来抵御高温胁迫压力;高温胁迫可显著影响中华绒螯蟹肠道微生物结构组成变化,有害菌群Actinobacteriota门、Rhodococcus属和Morganella属显著升高;高温胁迫导致中华绒螯蟹肝胰腺22个差异代谢物(SDMs)显著上调,63个SDMs显著下调,主要包括氨基酸及其代谢产物、脂肪酸和杂环类化合物,这些SDMs富集注释在34条不同代谢通路中。
(2)中华绒螯蟹可通过调节LDH、CAT、SOD、MDA、T-AOC、AKP、ACP、AST、ALT等抗氧化和免疫酶活性,以及HSP 70、HSP 90、Relish、proPO等基因的表达来抵御低温胁迫压力;低温胁迫对中华绒螯蟹肠道微生物结构组成产生显著影响,在属水平上,低温胁迫显著提高了Dechloromonas,Mariniflum,和unclassifed-f-Comamonadaceae的相对丰度,显著降低了Chitinibacter和unclassified-c-Alphaproteobacteria的相对丰度;低温胁迫导致中华绒螯蟹肝胰腺9个SDMs显著上调,8个SDMs显著下调,主要包括氨基酸及其代谢物、苯及其取代衍生物、脂肪酸、生物碱、激素及相关化合物,这些SDMs富集注释在10条不同代谢通路中。
参考文献(略)
