本文是一篇医学论文,本研究借助10× Genomics 单细胞转录组测序分析,从单细胞水平对DEHP暴露诱发睾丸发育毒性的机制进行剖析,并结合分子生物学等技术手段进一步阐明DEHP抑制生精细胞减数分裂的分子机制。
1、引言
1.1 DEHP的简介
邻苯二甲酸二(2-乙基己基)酯(di(2-ethylhexyl) phthalate,DEHP)是邻苯二甲酸脂类(phthalate acid esters,PAEs)中最常见的成员,化学式为C24H38O4,外观为无色或淡黄色粘稠液体,不溶于水,但能与一般有机溶剂混溶。在世界卫生组织国际癌症研究机构公布的致癌物清单中,DEHP属于2B类致癌物[1]。欧洲食品安全局规定其每日可耐受摄入量为50μg/kg[2]。
塑料制品老化会使DEHP逸散到周围环境中,食品包装中的DEHP也会浸出到食品中,使人体易于暴露于DEHP。尤其是当塑料制品包装油性食品时,塑料制品中的DEHP向食品中的迁移量明显增加,食品中能检测到较多DEHP,包装水性食品时DEHP未检出[6]。另外塑料制品中的DEHP在温度较高时以及接触食品时间较长时,会向食品中有较大迁移量[7]。目前的研究发现,竹木筷、保鲜膜、奶嘴等直接接触食品的物品中的DEHP可能向直接接触的食品中迁移[7-9],白酒、水果、食用油、冲调奶、复合调味料、瓶装水等食品中均能检测到DEHP[9-14]。甚至由于在许多塑料制品中的过度使用,还可以在汽车内饰、宿舍灰尘、空气、水源和土壤中发现DEHP的存在[5, 15, 16]。也因此,目前的研究发现,很多国家和地区的不同年龄段人群的尿液中均能检测到DEHP及其多种体内代谢物[17]。据有毒物质和疾病登记署(Agency for Toxic Substances and Disease Registry,ASTDR)评估,一般人群每天能接触到的DEHP剂量最大为2mg/day[18],相当于体重70公斤的人暴露剂量为28.6μg/kg/day,尚在欧洲食品安全局规定的50μg/kg的可耐受剂量范围中。
.............................
1.2 DEHP的危害
DEHP是邻苯二甲酸的二酯,存在两条含有酯基的侧链,被机体摄入和吸收后,肝脏和血液中的酯酶会将其迅速水解成单酯形式,包括邻苯二甲酸单乙酯(monoethyl phthalate,MEP)、邻苯二甲酸单丁酯(monobutyl phthalate,MBP)、邻苯二甲酸单戊酯(monopentyl phthalate,MPP)、邻苯二甲酸单甲酯(monomethyl phthalate,MMP)、邻苯二甲酸单己酯(monohexyl phthalate,MHP)、邻苯二甲酸单丙酯(monopropyl phthalate,MPrP)、邻苯二甲酸单(2-乙基己基)酯(mono-(2-ethyhexyl) phthalate,MEHP)等多种活性代谢物[21],被认为是PAEs的终极毒物,其具有的类雌激素活性,使其可以作为内分泌干扰物来影响机体的内分泌功能[22]。
DEHP有可能影响睾丸、卵巢、肝、肾、心脏、神经等全身多个器官和组织,和多个体内代谢过程[23]。研究表明,孕期母体小鼠DEHP暴露会导致新生子代小鼠体重下降,海马体氧化应激增加[24],神经递质水平以及相关酶活性改变[25],下丘脑中生殖和能量代谢相关基因的转录和蛋白表达受影响[26]。研究表明,孕期母体DEHP暴露还可能引起子代胰岛素分泌减少、空腹血糖升高,影响血糖稳态[27]。研究表明,DEHP的代谢物通过降低超氧化物歧化酶的活性来促进ROS的产生,导致代谢从糖酵解途径转向磷酸戊糖途径,引起依赖糖酵解产生能量的造血细胞死亡,可以影响骨髓造血[28]。研究发现,邻苯二甲酸盐暴露可能会干扰怀孕期间的甲状腺系统,引起甲状腺破坏作用以及甲状腺标志物升高[29]。研究发现,DEHP会导致肠道微生物群区系和组成发生变化,多样性降低,细菌代谢物水平改变,醋酸纤维菌属、梭状芽胞杆菌属、乳酸杆菌属、乳球菌属数量减少,阿克曼菌属、罗勒螺菌属数量增加[30],引起肠道微生态紊乱,还会引起短链脂肪酸水平改变、卵巢氧化应激和全身炎症[31]。我们主要着眼于DEHP对雄性生殖系统的影响。
.....................
2、材料与方法
2.1 实验材料
2.1.1 实验动物
6-7周龄C57/BL6J品系雌性及雄性小鼠均购买于北京维通利华实验动物技术有限公司。实验程序经深圳大学医学院机构动物护理与使用委员会批准(批准号:IACUC-202300086),按照标准的饲养要求,动物房每天都通过空调维持室温在24±0.5℃,空气湿度保持在30%,使用自动控制的灯光保持12h/d光照和12h/d黑暗循环交替。同时给予充足的饮水和小鼠生长繁殖所需饲料,小鼠可以自由饮水和采食。新购买的小鼠在送到、称重记录并分笼之后、开始实验前,提前在动物房内适应生存环境至少饲养一周的时间,以降低运输产生的应激反应。
雌性和雄性小鼠周龄满8周以后,每天下午5点钟选出状态良好的、发情的雌性小鼠与雄性小鼠进行合笼,第二天上午9点钟检查每只合笼的雌鼠阴道口处是否出现阴道栓,出现阴道栓的雌鼠被挑选出来在另外的鼠笼中单独饲养,记录见栓时间,并且记录为怀孕0.5天。
2.1.2 主要实验试剂
在本实验中用到的主要试剂信息情况如下表所示:
医学论文怎么写
..........................
2.2 实验方法
2.2.1 药物处理及试验分组
根据欧洲食品安全局标准,DEHP的安全暴露剂量为50μg/kg体重,我们制定了40μg/kg以及80μg/kg的暴露剂量腹腔注射的DEHP暴露模型。将新生的ICR雄鼠分为3组,分别为0μg/kg/d的对照组、40μg/kg/d的低浓度DEHP处理组和80μg/kg/d的高浓度DEHP处理组,从PD5开始腹腔注射,称重后,按照每g小鼠体重注射1μL相应组别的工作液的方法,并给对照组注射生理盐水,每g小鼠体重注射1μL生理盐水,均持续至PD10和PD15收集睾丸样品,研究DEHP暴露对雄性小鼠早期减数分裂的影响。
2.2.2 睾丸收样
PD5的雄鼠在腹腔注射处理至PD10和PD15时收样,PD5的雄鼠在腹腔注射处理至PD15后,继续饲养至PD35时收样。注射法处死后,解剖取出两侧睾丸,一个形态较好的睾丸置于提前准备好的1.5mL离心管中的1mL4%多聚甲醛中固定,另一个睾丸浸泡入提前准备好的培养皿中的生理盐水中,使用PBS清洗后去除小鼠睾丸包膜,用镊子将其中的曲细精管分成两部分,一少部分用于稍后制备SC铺片,另外一部分放入1.5mL离心管中,置于-80℃超低温冰箱冷冻保存用于后续的实验。
.....................
3、结果 ........................... 19
3.1 不同处理组雄性小鼠睾丸单细胞转录组基因表达谱差异分析 ........................ 19
3.1.1 DEHP对早期减数分裂的抑制作用及细胞类型鉴定 ................................... 19
3.1.2 生殖细胞亚群鉴定 ..................................... 21
4、讨论 ..................... 33
5、结论 ............................ 37
4、讨论
哺乳期DEHP暴露会导致子代雄性生殖系统损伤,包括睾丸重量下降[47]、血睾屏障受损[36]、睾丸生殖细胞和体细胞数量减少[48]、减数分裂相关蛋白表达水平降低等结果[32]。我们使用腹腔注射的方式使哺乳期雄鼠暴露于DEHP,也产生了相似的效果。目前发现的DEHP损伤男性精子发生过程的机制主要包括,GABA能系统改变[49],AhR信号激活和促性腺激素表达改变直接影响垂体功能[50-52],氧化应激、细胞周期和甾体生成相关通路改变[53],RNA降解[54],RNA甲基化[55],精小管周围巨噬细胞以及睾丸炎症反应[56-58],凋亡、自噬加强[59, 60],焦亡途经激活[61],精子发生相关基因启动子DNA高甲基化和表达下调[62-64],内质网应激[65],精浆代谢物改变[66]等。研究发现支持细胞在精子发生中起着重要作用[67],于是我们进一步研究了其中的机制,发现支持细胞-生殖细胞的细胞通讯在DEHP损伤男性精子发生过程中发挥重要作用,还观察到了DEHP对雄性生殖系统发育的持续性毒性作用。
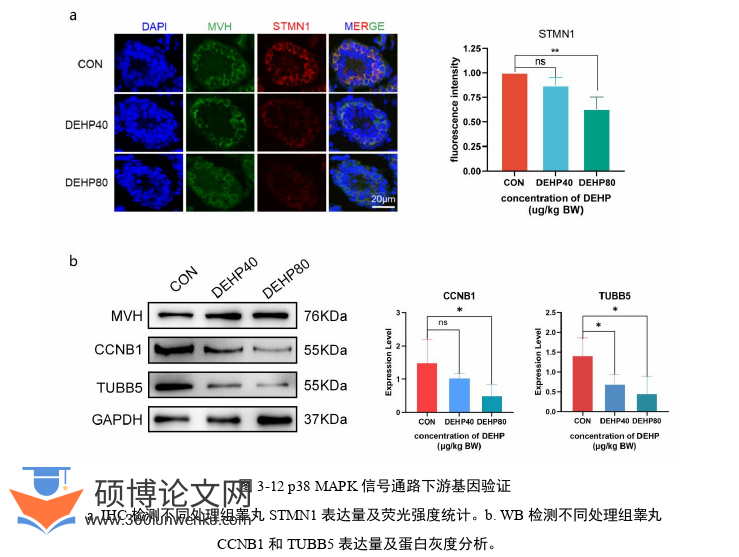
首先,我们确定了DEHP影响哺乳期雄鼠早期减数分裂进程的表型。精子发生的全过程包括精原细胞的更新分化、精母细胞的成熟分裂和精子细胞变态三个阶段。精原细胞分为A、B两种类型,A型精原细胞按照分化过程进一步分为As、Apr、Aal,A1、A2、A3、A4,以及中间型精原细胞。中间型精原细胞分裂为两个B型精原细胞。B型精原细胞分裂增殖为初级精母细胞,进入第一次减数分裂阶段[40]。第一次减数分裂前期特别长,在这一时期中存在一种特殊结构联会复合体(SC)[41],根据SC的形态主要分为细线期、偶线期、粗线期、双线期四个时期。使用染色体联会复合物检测技术,检测不同浓度DEHP处理的PD10和PD15的小鼠睾丸,处于细线期、偶线期、粗线期、双线期的生殖细胞的数量的比例,并利用Western blotting检测了睾丸中生殖细胞特异性标志基因Ddx4和联会复合体相关基因Sycp3的表达量。结果发现与我们之前的研究相似,DEHP处理导致细线期生殖细胞的比例明显上升,并且这两个基因表达量明显下降,说明DEHP能够抑制雄性生殖细胞的减数分裂进程,并且不同浓度的DEHP暴露对出生后雄鼠早期减数分裂进程有相似的抑制作用。
医学论文参考
................................
5、结论
本研究借助10× Genomics 单细胞转录组测序分析,从单细胞水平对DEHP暴露诱发睾丸发育毒性的机制进行剖析,并结合分子生物学等技术手段进一步阐明DEHP抑制生精细胞减数分裂的分子机制。我们的研究最终得出以下结论:1、DEHP抑制雄性小鼠早期减数分裂,主要是通过抑制p38 MAPK信号通路进行的;2、不同浓度的DEHP有相似的抑制效果;3、在减数分裂早期DEHP暴露时,常见的核心模块基因具有相似的表达模式;4、DEHP暴露于减数分裂早期对雄性生殖系统发育有持续的毒性作用。本研究将塑化剂危害生殖发育的研究推向深入,为解决环境问题诱发的男性不育提供理论和技术支持。
参考文献(略)
