本文是一篇医学论文,本研究通过抑制IRF3的磷酸化和核易位,进而阻抑RLRs信号通路激活和IFN-β产生,从而达到促进病毒增殖的目的。这些结果对进一步阐明MRV结构蛋白介导的天然免疫机制奠定了基础,为预防和控制MRV感染提供新思路。
第一章文献综述
1哺乳动物呼肠孤病毒
呼肠孤病毒(Mammalian reovirus,MRV)被称为广泛感染病毒,感染的主要宿主包括猪、犬、牛以及人类,它是一种重要的人畜共患病原体,且对宿主具有高度的致病性[1]。该病毒主要入侵宿主的胃肠道,以及呼吸系统,可促使宿主具有发热,呼吸道感染以及胃肠炎等症状。从被感染宿主的组织器官中可利用病原学方法分离该病毒,MRV病毒在人类的疾病致病过程中起到辅助和促进作用[2],近年来,研究发现野生动物MRV病毒与人的MRV病毒的亲缘性很高,且野生动物的MRV病毒的感染毒强,在很多物种上进行传播,对人类的生命健康及卫生和经济带来巨大的威胁和损失。
1.1 MRV来历和分类
20世纪50~60年代,Albert Sabin和Leon Rosen等科学研究工作者首次从儿童的粪便样品中分离得到这类病毒,当时人们对它的致病机理不明确,鉴于其感染部位为呼吸道及肠道,因此就称它为呼吸道(respiratory)、肠道(enteric)、孤儿(orphan)病毒,简称呼肠孤病毒(Respiratory enteric orphan virus)[5,6]。正呼肠孤病毒属包括:哺乳动物正呼肠孤病毒(MRV)、狒狒正呼肠孤病毒(BRV)、禽正呼肠孤病毒(ARV)、爬虫类正呼肠孤病毒(RRV)、纳尔逊海湾正呼肠孤病毒(NBV)根据病毒与细胞融合的能力,把它分为非膜融合病毒和膜融合病毒,正呼肠孤病毒除了MRV外,其它病毒都能发生细胞融合[3]。
根据红细胞血凝性,MRV可分为4种血清型:代表株分别为血清1型(T1L,Lang),分离于健康儿童咽粘液和大便;血清2型(T2J,Jones),从腹泻儿童的大便中分离得到;血清3型(T3D,Dearing.T3A,Abney),从腹泻儿童的大便和发热儿童的上呼吸道中分离得到;血清4型(NEDV,Ndelle virus),从小鼠的脑和肝脏中分离得到[1,4]。
...................................
2 MRV参与免疫应答的研究进展
2.1 RLRs/MAVS信号途径
先天免疫系统是宿主抵御病原体的第一道防线。先天免疫细胞表达特定的模式识别受体,识别被称为病原体相关分子模式的微生物成分。例如:病毒核酸和蛋白质。这些模式识别受体的参与触发一系列信号通路,最终产生I型干扰素等抗病毒介质。线粒体抗病毒信号蛋白(MAVS)作为RLRs信号通路启动信号转导的中心枢纽,主要识别的是RNA病毒。MAVS的表达和功能受到转录后和翻译后两种机制的调控。很多的研究结果表明,病毒可以通过抑制MAVS信号通路的一个或者几个靶点来逃避宿主的先天免疫应答,继而能够使病毒存活和复制[26]。
RNA病毒引起的感染对全球人类健康构成重大威胁。更好地了解免疫系统如何控制RNA病毒感染对于开发新的治疗方法和疫苗至关重要。RLRs作为胞质双链RNA病毒的传感器已经被进行广泛研究。现已明确,RLR家族有不同的家族成员:RIG-I、MDA5、LGP2,它们是含有DExD/H盒子的RNA解旋酶,并且在细胞质中普遍表达。这些RLR通常具有一个中央解旋酶结构域和一个C端结构域(CTD),这对RNA识别至关重要。RIG-I和MDA5在它们的Neterminal区域也含有串联的caspase招募结构域(CARD)。在病毒识别后,RIG-I和MDA5与线粒体抗病毒信号蛋白(MAVS,也称为IPS1、VISA和CARDIF)相互作用,诱导转录因子干扰素调节因子3和7(IRF3/7)和核转录因子-κB(NF-κB)的激活。RIG-I和MDA5是典型的模式识别受体。而LGP2不含有N端CARD,在一些体外研究中,显示出LGP2在RIG-I/MDA5介导的信号传导中起负调控作用[27,28,29]。但在应对包括脑心肌炎病毒(EMCV)在内的小核糖核酸病毒时,LGP2参与MDA5介导的信号传导的激活。因此LGP2被认为是RIG-I和MDA5的调节因子介导的信号转导[30,31]。这一过程最终导致多种促炎性因子以及一些抗病毒基因的转录,例如干扰素和干扰素刺激基因(ISGs),它们能够使病毒的复制和传播受到抑制[32,33,34,35]。
............................
第二章MRVµ1蛋白对RLRs信号通路的调控作用研究
1实验材料
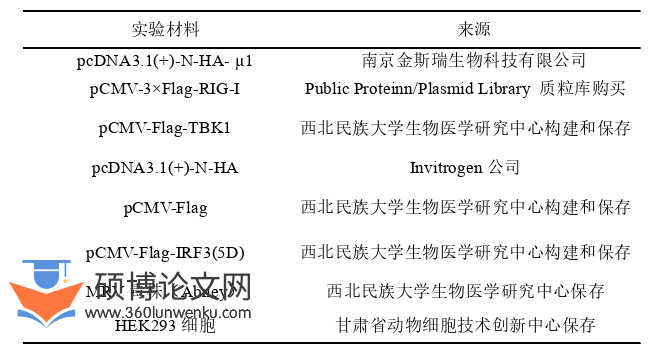
1.1细胞、质粒和病毒
MRV能够感染不同种类的宿主,几乎感染人和所有的哺乳动物。呼肠孤病毒的基因组为RNA,在感染的过程中可以产生5’pp-RNA结构,这两种形式的非自身RNA结构均能够激活MAVS介导的宿主天然免疫反应[50]。MRV基因组分节段的特点,导致不同MRV毒株之间很容易就会发生基因重组现象。分析导致人、猪以及水貂等哺乳动物发生腹泻的MRV毒株各基因节段的遗传演化过程,发现这些毒株与野生动物源的MRV毒株亲缘关系非常接近,极有可能是在蝙蝠等野生动物体内发生重组,然后传播感染人和其他哺乳动物[51,52,53]。研究证实,引起人类爆发的许多烈性病毒性疾病的病原来源于野生动物,并跨越物种在人类以及其他动物之间传播。而且已经有报道关于蝙蝠源呼肠孤病毒对人类有致病性且疑似人与人之间传播[54]。
医学论文怎么写
.............................
2实验方法
2.1 MRVμ1蛋白对MRV病毒增殖的影响
2.1.1细胞复苏与培养
在冻存种子细胞的液氮灌中,各取出一支HEK293和MDBK细胞,并在37℃左右温水中迅速摇晃使其融化,用离心机850 rpm,10min离心。然后在超净工作台上,用75%酒精棉球擦拭细胞冻存管,进行3次消毒。然后弃掉冻存管中上清细胞冻存液,把1 mL相对应配置好的细胞培养基加入冻存管内,然后轻轻地吹悬冻存管底部的细胞沉淀。下一步将重悬的种子细胞液加入有新鲜培养基的细胞培养瓶中。放置在37℃、5%CO2细胞培养箱中。然后在显微镜下对生长的细胞进行形态和生长状态的观察,如果细胞密度达到95%以上,生长状态良好而且形态饱满就可以弃掉培养瓶中的旧培养基,先加入2mL 0.25%胰蛋白酶润洗一遍,再加入2mL 0.25%胰蛋白酶进行消化。当细胞出现雾状以及针孔状并且沿细胞瓶壁脱落时,此时弃掉细胞瓶中的胰蛋白酶,加入10 mL左右配置好的相对应的细胞培养基终止细胞的消化并用吸管吹悬细胞。最后按照适宜的比例分装细胞悬液在新的细胞培养瓶中,并加入适量的培养基。摇晃均匀后放置在37℃。5%CO2细胞培养箱中培养。培养24h左右至细胞生长密度达至95%以上时后继续进行传代培养。
2.1.2 MRV培养与扩增
在37℃、5%CO2培养箱中取出细胞形态和生长状态良好的MDBK细胞,先用1×PBS漂洗三次,然后加入用无血清DMEM培养基稀释的MRV病毒,细胞培养瓶与加入毒液的比例为10:1对MDBK细胞进行感染,然后放置于37℃、5%CO2培养箱中孵育2 h,最后弃掉上清加入稀释MRV的培养基,加入10%NBS DMEM细胞培养基,在37℃、5%CO2培养箱中继续培养,观察细胞出现病变后将细胞瓶放在-80℃冰箱,反复冻融三次,最后一次融化后用50 mL离心管收集培养液,5000r/min,4℃,10min,收集上清即为MRV细胞全毒。
.............................
第三章 MRV μ1 抑制 RLRs 信号通路的作用机制研究 ................... 25
1 实验材料 ....................................... 25
1.1 细胞及质粒 ...................................... 25
1.2 主要试剂 .......................................... 25
第四章 全文总结 ........................... 36
3实验结果
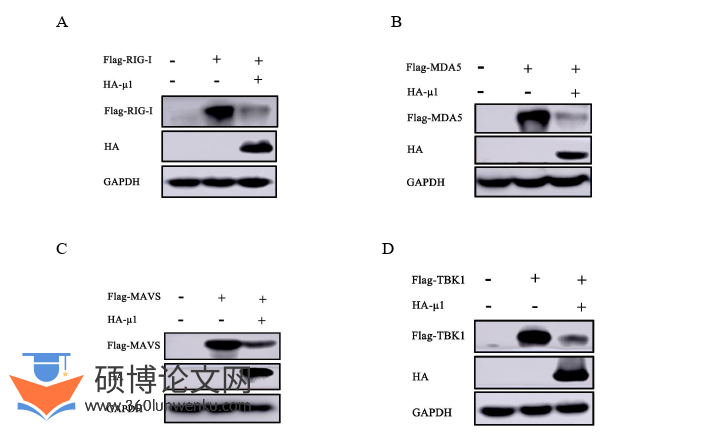
3.1µ1蛋白对RLRs通路关键因子蛋白表达的影响
通过Western blotting检测µ1对RLRs关键蛋白表达水平的影响,检测了µ1对RLRs信号通路中关键蛋白RIG-I、MDA5、MAVS、TBK1和IRF3蛋白表达水平的影响,发现µ1显著抑制RLRs信号通路蛋白关键蛋白RIG-I、MDA5、MAVS、TBK1和IRF3的表达水平。(图3-1A、图3-1B、图3-1C、图3-1D和图3-1E)
医学论文怎么写
............................
第四章全文总结
1.MRVμ1蛋白可显著促进MRV体外增殖。
2.MRVμ1蛋白能够明显抑制RLRs信号通路中RIG-I、MDA5、MAVS、TBK1和IRF3的蛋白表达,而且μ1抑制poly(I:C)以及病毒介导的IFN-β的产生。
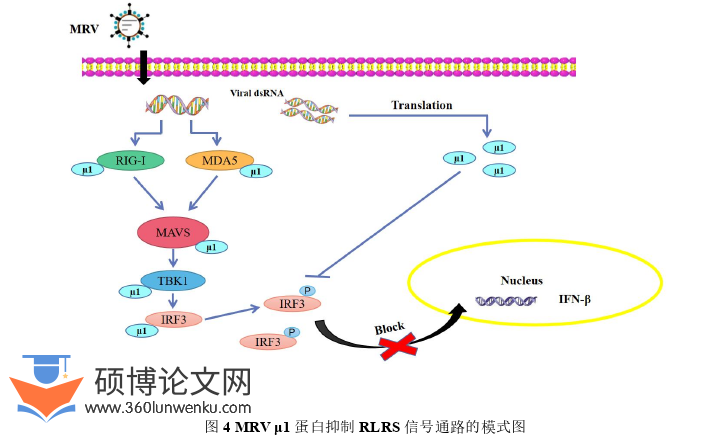
3.通过免疫共沉淀实验,结果证明MRVμ1蛋白和RLRs信号通路关键蛋白RIG-I、MDA5、MAVS、TBK1和IRF3存在相互作用;通过激光共聚焦分析,结果证明MRVμ1蛋白和IRF3在细胞质中存在共定位以及抑制IRF3的入核情况;核质分离实验,结果证明MRVμ1蛋白抑制IRF3的磷酸化和入核。
综上,本研究首次证明了MRVμ1蛋白与RLRs信号通路关键蛋白RIG-I、MDA5、MAVS、TBK1和IRF3存在相互作用,并通过抑制IRF3的磷酸化和核易位,进而阻抑RLRs信号通路激活和IFN-β产生(图4),从而达到促进病毒增殖的目的。这些结果对进一步阐明MRV结构蛋白介导的天然免疫机制奠定了基础,为预防和控制MRV感染提供新思路。
医学论文参考
参考文献(略)
