本文是一篇药学论文,笔者通过研究灰兜巴不同溶剂提取部分对PPARγ的激活作用,选择激活作用最强的提取部分,研究激活PPARγ后对高糖诱导下的肾小管上皮细胞HK-2中层粗连蛋白(Laminin,LN)、纤维连接蛋白(Fibronectin,FN)、TGF-β、结缔组织生长因子(Connective tissue growth factor,CTGF)、p-Smad2/3等相关蛋白表达的影响,探讨灰兜巴通过激活PPARγ抑制TGF-β/Smad信号通路,减轻高糖诱导的HK-2细胞纤维化机制。
材料与方法
1仪器与材料
1.1实验仪器

药学论文怎么写
........................
1.3主要试剂的配制
①膜封闭液:称取1g脱脂奶粉,溶于20mL TBST溶液中,涡旋混匀后,置于摇床30min,室温放置,现配现用;
②APS(10%):称取1g过硫酸铵粉溶于10mL超纯水中,涡旋混匀后,分装于1.5mL的EP管中,−20°C冰箱冻存备用;
③5×SDS-PAGE电泳缓冲液:称取5g SDS、15.1g Tris和94g甘氨酸添加至1L锥形瓶中,用超纯水定容至1L;
④1×SDS-PAGE电泳缓冲液:取200mL 5×SDS-PAGE的电泳缓冲液添加至1L容量瓶中,超纯水定容至1L;
⑤1×TBST:称取8.8gNaCl、20mL 1M Tris-HCl(pH8.0)、800mL去离子水溶解,再添加0.5mL Tween-20;
⑥5×转膜缓冲液:称取Tris 15.1g、甘氨酸76g,置于1L容量瓶中,超纯水定容至1L,混匀,室温放置;
⑦1×转膜缓冲液:使用量筒取200mL 5×转膜缓冲液、200mL甲醇、超纯水定容至1L,混匀后使用;
⑧细胞完全培养基:5mL胎牛血清,500μL的青链霉素抗生素,加入MEM培养基至50mL;
⑨细胞冻存液:500μL DMSO,4.5mL 胎牛血清,5mL MEM。
..........................
2实验方法
2.2 HK-2细胞高糖模型的构建
查阅文献可知,常用的处理肾小管上皮细胞的高糖条件是加入30mmol/L的葡萄糖[6-7]。将消化的细胞计数后,以2×105/mL的密度接种至六孔板中,培养24h,待细胞贴壁,融合率达70%~90%,取出细胞,给药,分组如下:
①对照组:在细胞中加入2mL的完全培养基,置于37℃,5%CO2的恒温细胞培养箱中培养;
②24h组:在细胞中添加含葡萄糖浓度为30mmol/L的培养基2mL,置于37℃,5%CO2的恒温细胞培养箱中培养24h;
③48h组:在细胞中添加含葡萄糖浓度为30mmol/L的培养基2mL,置于37℃,5%CO2的恒温细胞培养箱中培养48h;
④72h组:在细胞中添加含葡萄糖浓度为30mmol/L的培养基2mL,置于37℃,5%CO2的恒温细胞培养箱中培养72h。
经不同处理后,收集细胞上清液,测定上清液中FN、LN的含量,确定造模时间。
...........................
2.3灰兜巴STC对高糖刺激下HK-2细胞的影响
将生长状况良好的细胞进行消化计数,以2×105/mL的密度接种到100mm的培养皿中,培养24h,待细胞贴壁,融合率达70%~90%,取出细胞,给药,分组如下:
①对照组:HK-2细胞培养24h后,更换MEM继续培养48h,再更换培养液,培养24h;
②模型组:HK-2细胞培养24h后,更换MEM,加入30mmol/L葡萄糖作用48h,更换MEM,再加入浓度为30mmol/L的葡萄糖培养24h;
③吡格列酮组:HK-2细胞培养24h后,更换MEM,加入浓度为30mmol/L葡萄糖作用48h,更换培养液,加入终浓度为30mmol/L的葡萄糖和浓度为0.75μg/mL的吡格列酮培养24h;
④灰兜巴STC高浓度组:HK-2细胞培养24h后,更换MEM,加入浓度为30mmol/L葡萄糖作用48h,更换培养液,加入浓度为30mmol/L的葡萄糖和浓度为400μg/mL的灰兜巴STC培养24h;
⑤灰兜巴STC中浓度组:HK-2细胞培养24h后,更换MEM,加入浓度为30mmol/L葡萄糖作用48h,更换培养液,加入浓度为30mmol/L的葡萄糖和浓度为200μg/mL的灰兜巴STC培养24h;
⑥灰兜巴STC低浓度组:HK-2细胞培养24h后,更换MEM,加入浓度为30mmol/L葡萄糖作用48h,更换培养液,加入终浓度为30mmol/L的葡萄糖和终浓度为100μg/mL的灰兜巴STC培养24h。
..........................
第三部分灰兜巴激活PPARγ抑制TGF-β/Smad信号通路改善高糖诱导HK-2细胞纤维化的机制研究…………………………41
前言………………………………41
1材料与方法…………………41
结果……………………………49
讨论…………………………55
小结………………………57
5讨论
肾脏纤维化是糖尿病肾病晚期的主要病理特征[8],在肾脏纤维化发展过程中,30%~40%肾小管上皮细胞发挥着重要作用[9],其病变是糖尿病肾脏纤维化病理改变之一[10]。各种细胞外的异常信号如TGF-β激活、CTGF和AGEs堆积、FN和LN的增多、活性氧增加、血流动力学改变等均可使肾小管上皮细胞功能与结构发生改变,分泌过量ECM,造成ECM沉积[11-13]。随着ECM堆积及多种细胞因子的释放,肾脏纤维化也会逐渐加重。因此抑制肾小管上皮细胞病理改变,减少纤维化细胞因子的产生和ECM的堆积[14],可以有效延缓糖尿病肾脏纤维化的进程。其发病机制与多种因素有关,其中PPARγ的激活就可降低ECM的沉积和相关细胞因子的表达,因此本实验进一步探讨了灰兜巴STC是否通过激活PPARγ而抑制TGF-β/Smad通路下调肾脏纤维化各种蛋白的表达改善糖尿病肾脏纤维化。
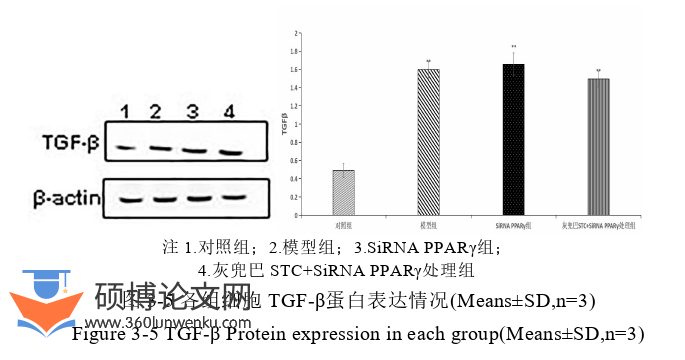
高糖环境是糖尿病肾脏纤维化发生、发展的重要原因,本实验用30mmol/L的葡萄糖刺激肾小管上皮细胞,模拟糖尿病肾脏纤维化模型。进行了葡萄糖作用时间摸索,以寻找合适的造模时间。实验结果表明,随着葡萄糖作用时间的增加,上清液中FN、LN的表达逐渐升高,与对照组相比,处理时间为72h细胞上清液中的FN、LN含量显著升高,最终选取造模作用时间为72h。实验结果显示,高糖刺激下肾小管上皮细胞中的FN、LN、TGF-β、CTGF、p-Smad2/3等肾脏纤维化蛋白的表达较对照组显著升高,因此可得高糖可诱导肾小管上皮细胞形态、结构和功能发生改变。在上一部分的研究中我们得出,灰兜巴的一些溶剂提取部分可有效激活PPARγ,其中灰兜巴STC对PPARγ的激活效率最高,但灰兜巴STC是否通过激活PPARγ,达到延缓高糖诱导的HK-2细胞纤维化有待进一步研究。为了研究灰兜巴STC是否通过激活PPARγ抑制TGF-β/Smad通路从而延缓高糖引起的HK-2细胞纤维化,本实验首先通过WB、ELISA实验得出,灰兜巴STC可抑制TGF-β/Smad信号通路,降低FN、LN、TGF-β、CTGF、p-Smad2/3等肾脏纤维化相关蛋白的表达,且研究结果表明,高浓度灰兜巴STC对TGF-β/Smad信号通路抑制作用最强。
药学论文参考
..............................
小结
建立高糖诱导肾小管上皮细胞损伤模型,验证了TGF-β、CTGF、p-Smad2/3、FN、LN等肾脏纤维化相关蛋白过量表达,通过给予灰兜巴STC后,HK-2细胞纤维化相关蛋白表达显著降低,而SiRNAPPARγ组给予相同的灰兜巴STC后相关蛋白表达并未显著降低,因此可知灰兜巴STC抑制TGF-β/Smad信号通路改善高糖诱导的HK-2细胞纤维化与激活PPARγ有关。
参考文献(略)
