本文是一篇医学论文,本研究通过SA-β-gal实验和衰老相关基因(p16)表达量的检测,发现沉默HAS2相较于对照组促进hESCs的衰老。133个蛋白在pull down联合LC-MS/MS实验中捕获数值存在显著性差异。
第一章绪论
1.1 RIF的概述
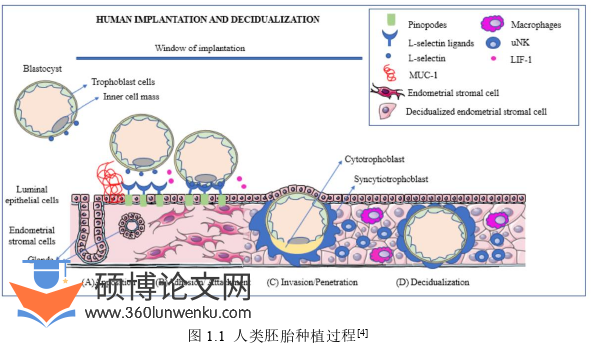
成功妊娠需要经历一系列有序而又复杂的生理学过程,包括胚胎着床、子宫内膜蜕膜化、胎盘形成以及最终足月胎儿的顺利娩出。胚胎植入是激活的囊胚与具有容受性的子宫相互作用并建立起牢固联系的过程。调节胚胎生长和分化的程序与调节子宫内膜容受性的分子程序同步,是自然受孕及IVF辅助受孕的关键时期,在早期妊娠的建立中发挥着至关重要的作用。在胚胎着床的过程中(如图1.1),子宫处于接受状态的时期被称为植入窗口期(window ofimplantation,WOI),在排卵后6至8天开始,持续约4天,此时子宫内膜的接受能力最强。植入窗口的持续时间较为短暂,通常是在月经周期的第21-23天(排卵后7-9天)[1]。子宫内膜容受性受损约是三分之二的着床失败的原因[2,3]。
医学论文参考
..............................
1.2 RNA m6A甲基化修饰的概述
RNA N6-甲基腺苷(N6-methyladenosine,m6A)甲基化修饰是近年国内外研究最前沿、热点的新兴领域之一。2017年《Nature》杂志专门以“An epigeneticsgold rush:new controls for gene expression[11]为题报道了围绕RNA甲基化修饰的新一轮表观遗传研究的黄金时代。在信使RNA(mRNA)和非编码RNA(non-coding RNAs,ncRNA)中已经发现了170多种不同的修饰[12],其中一半以上是RNA甲基化修饰[13]。m6A是位于N原子第6位的甲基化腺苷,是迄今为止研究最丰富的RNA甲基化修饰之一。自1974年首次发现m6A至今,m6A被确定为真核细胞中最普遍的mRNA内部化学修饰。约有0.1%-0.4%的转录本存在m6A修饰,主要富集在终止密码子周围,5'和3'非翻译区(untranslated regions,UTRs)的长内外显子中。其保守基序为RRACH(R=A或G,H=A,C或U)。目前研究证实m6A甲基化的形成和去除及其功能的发挥通过3类调节蛋白完成,分别是甲基转移酶(writers)、去甲基酶(erasers)和m6A结合蛋白(readers)(图1.2)。m6A修饰的形成是由包括METTL3[14],METTL14[15],WTAP[16,17],KIAA1429[18],METTL16[19],RBM15[20]和ZC3H13[21]在内的甲基转移酶(writers)复合物催化。可逆的m6A修饰被FTO和ALKBH5等去甲基化酶(erasers)去除[22,23]。m6A阅读蛋白(readers)可以识别m6A修饰的RNA,这些RNA分为不同的蛋白质家族。一类是m6A直接阅读蛋白,含有YT521-B同源性(YT521-B homology domainfamily,YTH)结构域,例如存在于细胞质中的YTHDF1/2/3,和存在于细胞核中的YTHDC1/2[24]。异质核糖核蛋白(heterogeneous nuclear ribonucleoproteins,HNRNPs)家族成员也起着重要作用,例如HNRNPA2B1,HNRNPC/G,主要调节靶转录本的选择性剪接或加工[25]。胰岛素样生长因子-2 mRNA结合蛋白(insulin-like growth factor-2 mRNA-binding protein,IGF2BP)家族,成员有IGF2BP1/2/3,起到稳定mRNA的作用[26]。这些调节因子介导的甲基化过程是动态且可逆的,并广泛参与调节RNA剪接[27],稳定性[28],翻译功能[29]和定位[30]。
..................................
第二章RNA m6A甲基化修饰相关酶在RIF患者植入“窗口期”子宫内膜组织中的表达情况
2.1研究背景
m6A是真核生物中最普遍的RNA内部化学修饰。它被证实为一种可逆的RNA修饰,更倾向于发生在终止密码子附近的DRACH基序和mRNA的长内显子中[45]。核甲基转移酶复合物由METTL3,METTL14,WTAP,VIRMA,ZC3H13,RBM15(或RBM15B)和CBLL1/HAKAI组成,以协同转录的方式催化m6A修饰,发挥m6A“writers”的作用[45,46]。特异性m6A去甲基化酶ALKBH5和FTO介导m6A的去甲基化,起到m6A“erasers”的作用[47]。包括含YTH结构域的蛋白质在内的多种蛋白质可以特异性结合m6A,发挥m6A“readers”的作用,并调节各种转录后过程,如RNA衰变、选择性剪接、翻译、多聚腺苷酸化和核输出等[48]。对于m6A的研究通常选择从3类m6A相关调节蛋白入手,m6A调节蛋白的表达模式在不同的组织中有所不同,其组织特异性使其成为潜在的生物标志物。
............................
2.2实验材料
2.2.1实验对象
该项目得到兰州大学第一医院生殖医学中心伦理委员会的批准和监督。所有样本均来自兰州大学第一医院生殖医学中心接受手术的患者。所纳入研究对象均被告知研究内容并签署知情同意书。本研究纳入“窗口期”内膜组织15例(其中RIF患者8例,对照组患者7例)。
RIF组纳入标准:①IVF/ICSI移植鲜胚或冻胚≥4枚且移植次数≥3次均种植失败的女性;②年龄<40岁、月经规律(28-35天);③基础血激素在正常范围内;④体重指数正常(BMI:18-24kg/m2)。
对照组纳入标准:①因输卵管因素或男方因素行IVF/ICSI-ET的女性,取样后的下一周期移植鲜胚或冻胚≤2枚成功妊娠;②年龄<40岁、月经规律(28-35天);③基础血激素处于正常范围;④体重指数处于正常范围(BMI:18-24kg/m2)
排除标准:3个月内激素药物使用、PCOS、EMS、子宫内膜息肉和子宫肌瘤、宫腔粘连或严重的全身性疾病、子宫畸形、卵巢手术史、盆腔结核史、甲状腺功能异常、高泌乳素血症、抗心磷脂抗体或狼疮抗凝剂检测阳性、免疫性不孕等。
2.2.2实验主要器材及试剂

医学论文怎么写
.........................
第三章RIF患者子宫内膜组织中RNA m6A甲基化修饰谱构建.......14
3.1研究背景..................................14
3.2实验材料..............................14
第四章HAS2在调节hESCs增殖和衰老中的功能机制研究.............32
4.1研究背景......................................32
4.2实验材料...........................33
第五章结论...........................46
第四章HAS2在调节hESCs增殖和衰老中的功能机制研究
4.1研究背景
透明质酸合成酶2(hyaluronic acid synthetase 2,HAS2)是一种存在于细胞膜上的关键酶,它合成高分子量透明质酸(high-molecular-weight hyaluronan,HMW-HA),并参与多种细胞功能,包括增殖、分化和炎症调控。HAS2已经被证实广泛参与维持增殖信号,逃避细胞凋亡,激活侵袭和转移以及能量代谢的重编程,可以在转录和翻译后等不同水平上受到调控。
绝大多数正常细胞被认为仅有有限的分裂能力,在不能分裂细胞失去增殖能力后就进入衰老(senescence)状态。衰老是一种与细胞应激相关的复杂现象[82,83]。衰老细胞的细胞周期分布也比较特殊,不同于一些损伤诱导的细胞休眠,也不同于细胞生长接触抑制的情况,衰老细胞在细胞周期的G1期不可逆地停滞,形成扁平、扩大的形态,并显示出与SA-β-gal相关的衰老活性增加[84]。近年来,越来越多的研究表明hESCs的衰老对子宫内膜容受性具有重要的意义。2022发表在《Human Reproduction》上的研究表明,hESCs的过早衰老可能会导致hESCs蜕膜化受损并影响胚胎的植入[85]。Chen等的研究则进一步证实患有RIF的年轻女性存在子宫内膜过早老化的现象且子宫内膜过早衰老与不良的生育结局相关[86]。Zhao等的研究也发现基质细胞衰老参与了种植窗期(WOI)子宫内膜免疫微环境的调节,细胞衰老相关基因有望作为RIF的新的诊断生物标志物[87]。综上所述,hESCs的衰老参与调控RIF患者的子宫内膜容受性,但其具体调控机制仍未阐明。
HAS2则被证实与细胞衰老有关,有研究表明下调HAS2的表达通过p27-CDK2-SKP2途径启动并调控成纤维细胞衰老[88,89]。HAS2被证实参与EMS的发病机制,血浆HA最近被提议可作为EMS的生物标志物[90]。丹参酮IIA磺酸钠治疗被证实通过抑制HAS2,诱导衰老来限制EMS的发展和纤维化[91]。除细胞衰老外,HAS2与细胞的增殖等生物学活动都紧密相关。有研究表示抑制肿瘤细胞中的HAS2通过阻滞G1期细胞的周期来抑制细胞增殖[83]。这些结果表明,HAS2在细胞的增殖和衰老中发挥重要作用。然而HAS2在RIF中发挥的作用尚不明确,在本章节中我们对HAS2如何影响hESCs的增殖和衰老进行研究。
...........................
第五章结论
在第二章中我们从3类m6A修饰相关酶入手,研究RNA m6A修饰相关酶在RIF患者“窗口期”子宫内膜组织中的表达情况。结果显示去甲基化酶ALKBH5和甲基化阅读蛋白YTHDF3在GEO验证和RT-qPCR验证中均在RIF患者植入“窗口期”子宫内膜组织中显著升高。
在第三章中通过MeRIP-seq进一步检测到RIF患者“窗口期”子宫内膜组织与对照组之间的mRNA m6A甲基化修饰谱存在显著差异。利用MeRIP-qPCR和RT-qPCR验证了CFTR、HAS2、ITGAD的m6A甲基化水平和表达水平。
在第四章中HAS2被筛选为关键基因。通过CCK-8实验和EdU掺入实验发现沉默HAS2抑制hESCs的细胞增殖能力。SA-β-gal实验和衰老相关分子p16的检测证实沉默HAS2促进hESCs的衰老。通过Pull down和LC-MS/MS实验探究与HAS2结合的蛋白多为核糖体蛋白。
本研究的不足与展望:在本研究的第二章中我们仅使用RT-qPCR技术检测了转录组上m6A修饰相关酶的表达情况,需要在下一步通过免疫组化和蛋白质免疫印迹法对m6A修饰相关酶在蛋白水平的表达情况做更深入的研究。HAS2对hESCs增殖和衰老的影响研究,可以更深入的通过细胞周期实验进行完善。对HAS2的研究尚且局限在对hESCs的生物学功能的影响上,通过pull down联合LC-MS/MS捕获到的蛋白,需要通过蛋白质免疫印迹法进行验证。Rescue实验和共表达载体的构建有助于更深入的探究HAS2与捕获到的结合蛋白之间如何相互作用的分子机制。
参考文献(略)
