本文是一篇农业论文,本研究将榆黄蘑中的病害病原菌分离鉴定,且通过菌丝生长抑制、MIC和MBC值、孢子萌发抑制率及EC50值、产孢量及对榆黄蘑菌丝的抑制影响,综合分析筛选出安全、有效地植物抑菌剂。
1 绪论
1.1 榆黄蘑概况
榆黄蘑(Pleurotus citrinipileatus),又名金顶侧耳、玉皇蘑、黄金菇等,隶属于担子菌亚门(Basidiomycotina),层菌纲(Hymenomycetes),伞菌目(Agaricales),侧耳科(Pleurotaceae),侧耳属(Pleurotus)[1],是近年来发展较快且栽培周期短的中高温特色食用菌[2]。榆黄蘑分布区域相当广泛,在中国,主要分布于东北地区,包括黑龙江、吉林、辽宁等地[3],除此之外,华北[4][5]、云贵川渝地区[6]-[9]等地也有分布;国外分布至日本、东南亚、欧洲、北美洲[10]等地。因其为木腐性食用菌[11],夏秋季节常生于榆、栎、槐、桐、杨、柳等阔叶枯立木干基部、伐桩和倒木上[12]。榆黄蘑不仅味道鲜美、肉质鲜嫩、香味浓郁[13]、具有营养丰富的食用价值,其营养成分主要包含蛋白质、脂肪、氨基酸、维生素等。其干品中粗蛋白质含量为41.5%;粗脂肪蛋白质为3.8%且脂肪酸多为不饱和脂肪酸,可降血脂;含有高达17种氨基酸,其中有八种人体必需氨基酸;富含B族维生素、维生素C、烟酸等[14]。同时又有滋补强身的药用价值,其提取的多糖物质证实具有抗氧化、降血压[15]、降血糖[16]、抗肿瘤[17]、抗肥胖、降血脂[18]以及护肝作用[19],因此被视为珍贵的食药兼用菌。除了本身具有丰富的营养价值和药用价值之外[20],近年来为了延长产业链,出现了榆黄蘑干制品[21]、榆黄蘑罐头[22]、榆黄蘑酱[23]、榆黄蘑饮品[24]等加工产品,进一步展现了榆黄蘑的经济价值。榆黄蘑产业是一个具有广阔前景和潜力的产业,应加强对榆黄蘑的研究,推动产业的持续发展,为乡村振兴和农民增收致富注入新的动力。
..........................
1.2 榆黄蘑主要真菌病害概述
1.2.1 榆黄蘑真菌病害发生的特点及原因
榆黄蘑等食用菌有较高的营养和经济价值,无论是在农业的增效,还是在农民的增收等方面,都发挥着极为重要的作用和积极意义[25]。
1.2.1.1 真菌病害发生的特点
①食用菌病害种类多,侵害范围广、隐蔽性强。常见的真菌性疾病包括链孢霉、木霉、毛霉等多种菌种,由于食用菌生长发育所需的环境等各方面条件与病原菌所需的生长条件相似,因此病原菌可与食用菌争夺养分。真菌性病原菌与食用菌属于同一类群,容易侵蚀菌丝和菇体正常生长。繁殖速度快,往往潜伏在菌袋内,病害发生初期不易发觉,一旦发现,已造成危害[26]。
②丰富的栽培基质为病原菌提供营养来源。栽培食用菌的基质以有机质为主,含有丰富的碳源、氮源、蛋白质及微量元素,给食用菌提供营养的同时,也给病原菌提供了养料,如链孢霉、木霉等孢子落入培养料中,就会快速长满菌袋,导致菌袋报废[27]。
③适宜的出菇环境为病原菌生长提供有利条件。榆黄蘑菌丝生长要求的适宜温度为10-26℃,培养料温度为60-65%,在此生态环境下也适合竞争性杂菌的生长。
..............................
2 榆黄蘑主要病害病原菌分离及鉴定
2.2 材料与方法
2.2.1 供试菌株
供试病原菌均分离自榆黄蘑染病菌袋。 榆黄蘑菌株和染病菌袋均由重庆市万州区龙驹镇灯台村智富森华农业专业合作社大棚食用菌栽培基地提供,两个榆黄蘑大棚的前门、中间和后门各采集三个菌袋,总共18份样品。
2.2.2 供试培养基及配方
马铃薯葡萄糖琼脂(PDA)培养基:葡萄糖20 g、琼脂20 g、土豆20 g、水1 L。用于病原菌的分离、纯化及鉴定。购自海博生物技术公司。 榆黄蘑栽培袋配方:棉籽壳40%、稻草40%、麦麸15%、石灰4%、石膏1%。以上物品均购自网店食用菌菌种材料店。
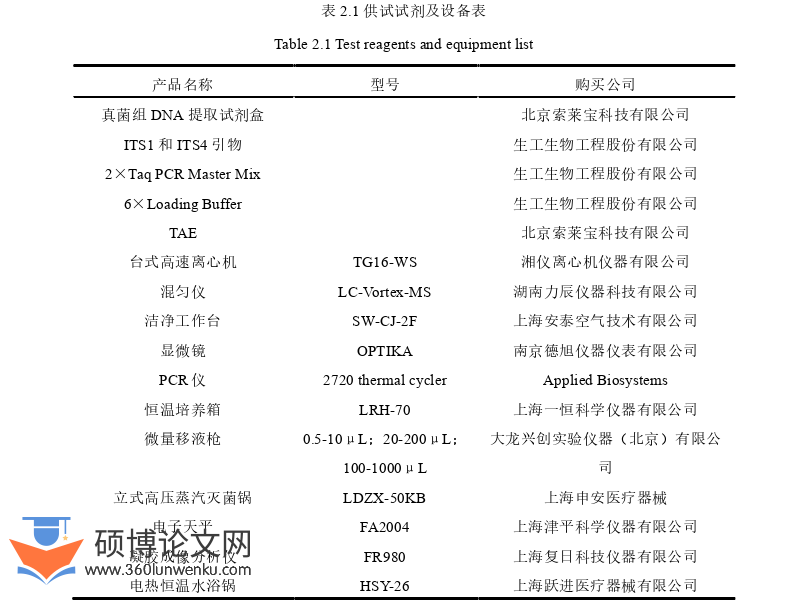
2.2.3 供试试剂及设备
农业论文怎么写
.........................
2.3 实验方法
2.3.1 病原菌的分离纯化
将染病菌包表面先用无菌水擦拭,后用75%乙醇溶液擦拭1 min进行表面消毒,放进预先紫外线灭菌得的净工作台中,用镊子夹取病斑组织接种到PDA平板上,在平板上做好标记,贴好封口膜,放置于28℃的恒温箱中培养48 h;待培养时间结束,挑取平板中不同形态的菌落,将生长均一,颜色一致的菌丝采用平板划线法转移到新的PDA培养基上进行培养[84]。如此重复纯化3次后,将得到的病原菌株转接于PDA平板上,待菌落大量孢子产生时放于4℃冰箱保存备用。
2.3.2 病原菌致病性测定
制作榆黄蘑培养袋:将棉籽壳、稻草和麦麸按配方比例称重后充分拌匀,将石膏和石灰溶于水中,同时加水将培养料加湿,水与培养料比例为1:1.2。拌好的培养料装进14 cm×28 cm的聚丙烯塑料袋中,装料时尽量将培养料压实,袋口用无棉盖体封口,以便保证透气性而不易被污染。采取高压蒸汽121℃,持续2 h的方式灭菌。待培养料温度降至30℃以下时接入榆黄蘑菌株,封紧袋口[85]。菌包于28℃培养5 d,观察是否产生杂菌,若无杂菌,在菌包中接种纯化的病原菌菌丝,再培养10 d。以不添加病原菌菌丝为空白对照。每个处理重复3次。待培养结束后观察榆黄蘑菌袋中的发病情况并记录。将发病菌袋中的病原菌再次分离出来,若分离出的病原菌与原接种病原菌特征相同,且空白对照均未发病,则确定该菌株为致病菌[86][87]。
.....................................
3 榆黄蘑病害植物抑菌剂的筛选 ...................... 22
3.1 引言 ..................................... 22
3.2 材料与方法 ......................... 22
4 结论与展望.................................... 45
4.1 结论 ..................................... 45
4.1.1 榆黄蘑病害病原菌的分离鉴定 ........................ 45
4.1.2 菌株Y1、Y5、Y12抑菌剂的筛选 ...................... 45
3 榆黄蘑病害植物抑菌剂的筛选
3.3 实验方法
3.3.1 植物提取液的制备
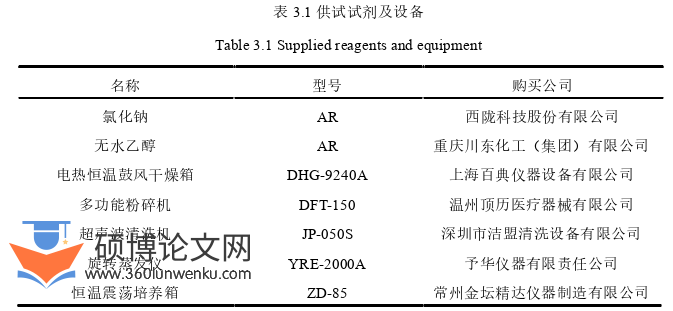
将植物置于50℃烘箱2 h烘干至恒重,并用粉碎机粉碎过60目筛,装袋编号。将分别取各植物粉末10 g于锥形瓶或三角瓶中,加入50 mL 50%的乙醇提取溶剂,用保鲜膜封口,于超声波仪中50℃,提取1.5 h得到浸提液,3000 r·min-1离心10 min,除去废渣,收集上清液,采用旋转蒸发仪进行减压浓缩,将上清液浓缩至10 mL,制成浓度为1.0 g/mL的抑菌活性物质,编号。为避免高温破坏植物提取液中的活性成分,采用细菌过滤器进行除菌[111][112],将制成的植物提取液于4℃冰箱中保存备用。
3.3.2 孢子悬浮液制备
将纯化的菌株于PDA培养基中28℃培养,待平板表面产生一层孢子层,在无菌操作下用加入10 mL无菌水,将孢子层刮下,将此孢子悬浮液转移到放置玻璃珠的锥形瓶中,充分震荡均匀后,用4层纱布过滤掉菌丝体,所得滤液为待测孢子悬浮液。取洁净的血球计数板计算孢子悬浮液中孢子的数量,将其浓度控制在106 个/mL,现配现用。
农业论文参考
..............................
4 结论与展望
4.1 结论
本研究将榆黄蘑中的病害病原菌分离鉴定,且通过菌丝生长抑制、MIC和MBC值、孢子萌发抑制率及EC50值、产孢量及对榆黄蘑菌丝的抑制影响,综合分析筛选出安全、有效地植物抑菌剂,得出以下结论:
4.1.1 榆黄蘑病害病原菌的分离鉴定
本研究从18个染病菌包样品中共分离20株病原菌,经形态学对比,有三株病原菌形态各异,经纯化培养后菌包回接,均产生致病现象。将三株病原菌接种PDA培养基中培养,待菌落成熟,结合形态学鉴定和分子生物鉴定两种方法,可将本次筛选的三株榆黄蘑病害病原菌鉴定为:Y1为链孢霉(Neurospora sitophila)、Y5为长枝木霉(Trichoderma longibrachiatum)、Y12为深绿木霉(Trichoderma atroviride)。
4.1.2 菌株Y1、Y5、Y12抑菌剂的筛选
综合分析各药用植物提取液分别对Y1、Y5、Y12菌株的菌丝生长抑制、MIC和MBC值、孢子萌发抑制率及EC50值、产孢量的影响以及对榆黄蘑菌丝生长抑制的影响。结论得出:
(1)远志提取液对Y1菌株的抑制效果最佳。当远志提取液浓度为1.0 g/mL时,对Y1菌丝的生长抑制率高达98.30%;远志提取液测定其对Y1菌丝的MIC、MBC分别为1.95 mg/mL、MBC=7.80 mg/mL;当远志提取液浓度为7.8 mg/mL时,Y1的孢子萌发抑制率为99.29%,EC50为0.1660 mg/mL,产孢量远低于空白对照,有效抑制Y1孢子的形成,对榆黄蘑菌丝的生长抑制率低于10%,对榆黄蘑菌丝的生长影响较小。
(2)黄连提取液对Y5菌株的抑制效果最佳。当黄连提取液的浓度为1.0 g/mL时,对Y5菌丝的生长抑制率为94.54%;黄连提取液对Y5的MIC、MBC分别为15.60 mg/mL、31.25 mg/mL;当黄连提取液浓度为31.25 mg/mL时,Y5孢子萌发抑制率为97.73%,EC50为1.0670 mg/mL,且产孢量低于空白对照,抑制Y5孢子的形成。
参考文献(略)
